reacție Zhabotinsky - - Belousov encyclopedia chimice
Belousov - reacția Zhabotinsky. care curge în avtokolebat. Modul katalitich. oxidare în dec. reducerea bromic la-unu NVrO3. În același timp, există fluctuații în concentrațiile formelor oxidate și reduse ale catalizatorului și a anumitor interm. produse. P-TION este în acid apos p-D; catalizatori în Qual-ve utilizarea ionilor de metal cu valență variabilă. de ex. Ce sau Mn, în Kutch-ve reducere - malonic la-tu, acetilacetonă, etc. Belousov. - reacția Zhabotinsky - Naib. a studiat o reacție oscilantă omogen. deschiderea unui roi stimulat o creștere bruscă a cercetării chimice. fluctuații și a dus la crearea unui nou domeniu de chimice. cinetică.
O diagramă simplificată Belousov - reacția Zhabotinskii include mai multe. Procesul: 1. lanț Ramificat p-TION oxidant autocatalyst NVrO2; Rezultatul este autoaccelerată catalizator de oxidare M n +.
2. Inhibarea oxidării prin rapidă p-TION, ramificat terminatori de lanț:
4. Reducerea formei oxidate a catalizatorului M (n + 1) + și inhibitorul formarea simultană - Br -.
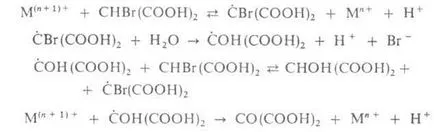
T. arr. un mecanism de p-TION poate fi reprezentat mnemonich. Circuit (Fig. 1), în care autocatalyst prevede NVrO2
Lay direct. Feedback-ul (indicat prin +), și se închide bucla otritsat inhibitor. Feedback-ul (-). Kolebat. ciclu poate fi descris calitativ după cum urmează. mod. Când concentrația de M (n + 1) + în sistem este suficient de mare, rata de Br - și concentrația acesteia în p-D, de asemenea, ridicat. Ca rezultat, p-TION oxidare în lanț M n + este inhibată, iar concentrația de M (n + 1) + picături, tinzând la valoarea sa de prag, realizând în același timp Br concentrație la- - scade brusc, și concentrare crește NVrO2. catena ramificata p-TION și concentrare accelerează M (n + 1) + începe să se ridice, tinzând sus. prag, atunci când concentrația la- Br - catena din nou crește brusc întrerupând ramificat și ciclul se repetă. Fluctuațiile în concentrațiile formelor oxidate și reduse ale catalizatorului sunt însoțite de oscilații colorat r-ra de la incolor la galben dacă catalizatorul - ioni de ceriu. sau de la albastru la roșu în complex caz fenantrolină fier [Fe (fen) 3].

Fig. Schema 1. Reacția Belousov - Zhabotinskii (RBr-bromo reducator).
Belousov - reacția Zhabotinsky prezintă un număr mare de dif. kolebat. moduri, la- depind de m-turii, aciditatea și concentrația reactanților inițiali. Perioada de oscilație poate varia de la zecimi de secundă până la zeci de minute. Există periodicitate simplă. fluctuații decembrie formează oscilații complexe cu mai multe. maxime într-o perioadă, și stocastică multifrecvență. fluctuații (vezi. Fig. 2). In timpul Belousov - reacția Zhabotinsky într-un sistem închis poate fi observat până la câteva. mii de cicluri; fluctuații în reactorul de flux menținut la infinit. In unstirred p-re, în cazul în care este eliminată prin convecție, sunt în curs de concentrare. val de auto-susținere care formează dinamice. Structura (Fig. 3).
P-TION B. P. Belousovym descoperită în 1951, a fost studiat în detaliu A. M. Zhabotinskim în 1964.
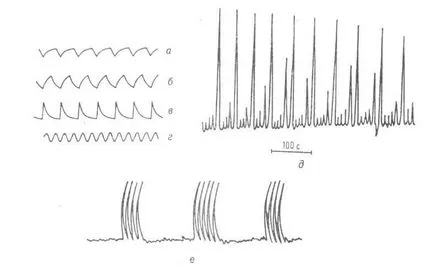
Fig. 2. decembrie Tipuri oscilații de concentrare Ce 4+ amestecare ideală în interiorul reactorului. și - în - oscilații cu dinți de fierăstrău descompunere. raportul dintre lungimea frontului și marginea din spate; r - oscilații sinusoidale; Dr. haotic. fluctuații; e-tranzitorii oscilații hard-periodice.
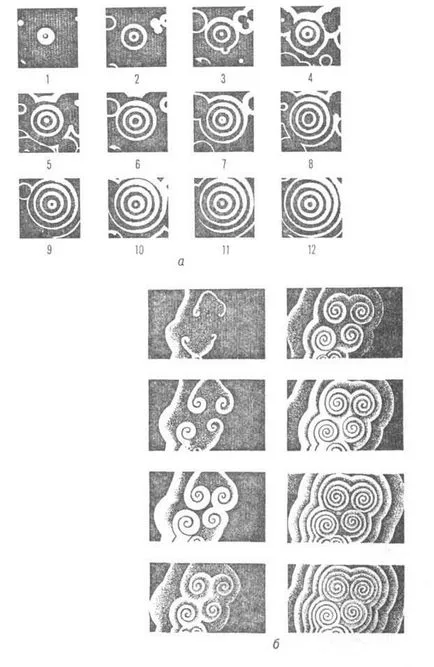
Fig. 3. Dinamic. structurile formate prin rularea de concentrare. valuri într-un strat subțire de catalizator neperemeshnvaemogo r-ra ([Fe (fen) 3], intervalul dintre cadre 15c; voln0,01 viteză cm / s): și - concentricitate. val dintr-o sursă punct - centrul de master; lungimea de undă de 0,55 cm; b - valuri în spirală; 0,15 cm.
===
App. Literatura pentru articolul „Belousov - reacție Zhabotinsky“. Zhabotinskiy A. M. oscilații de concentrare, M. 1974 LS Polak, Mihaylov A. S. Autoorganizarea în sistemele fizico-chimice neechilibru, M. 1983; Oscilații și valuri care călătoresc în sistemele chimice, N.7 Y. 1985.