proprietățile fizice și chimice generale ale metalelor, pregătirea pentru DH și examenul în chimie
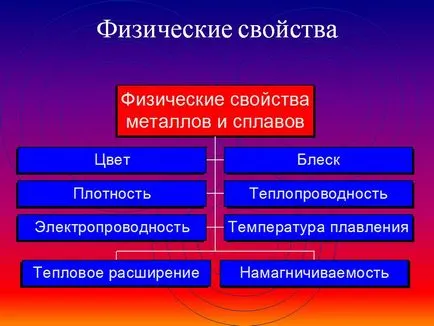
Proprietăți fizice generale ale metalelor
Datorită prezenței electronilor liberi ( „gaz de electroni“) în rețeaua cristalină a tuturor metalelor prezintă următoarele caracteristici în comun:
1) Ductilitatea - capacitatea de a schimba forma ușor trasă în sârmă, laminate în foi subțiri.
2) luciu metalic și opacitate. Acest lucru se datorează interacțiunii de electroni liberi și incidentul lumină asupra metalului.
3) Conductivitatea electrică. Acesta a explicat libera circulație direcțională a electronilor de la polul negativ la pozitiv sub influența o diferență de potențial mic. Atunci când este încălzit, conductivitatea electrică scade deoarece amplificat cu creșterea fluctuațiilor de temperatură ale atomilor și ionilor în rețeaua cristalină, ceea ce complică mișcarea direcțională „gaz de electroni“.
4) Conductivitatea termică. Datorită electronilor liberi de mobilitate ridicată, prin care o egalizare rapidă a temperaturii masei de metal. Cea mai înaltă conductivitate termică - bismut și mercur.
5) Duritate. Cea mai grea - crom (sticlă tăiate); cele mai moi - metale alcaline - potasiu, sodiu, rubidiu și cesiu - tăiat cu un cuțit.
6) Densitate. Este mai mică decât greutatea atomică mai mică și raza atomic mai mare de metal. Cel mai simplu - litiu (ρ = 0,53 g / cm3); cel mai greu - osmiu (ρ = 22,6 g / cm3). Metale având o densitate mai mică de 5 g / cm3 sunt considerate „metale ușoare“.
7) de topire și temperatura de fierbere. Cele mai multe fuzibil din metal - Mercur (punct de topire = -39 ° C), metalul cel mai refractar - (. T ° pl = 3390 ° C), tungsten. Metale cu punctul de topire t °. peste 1000 ° C sunt considerate refractare, mai mici - de topire scăzut.
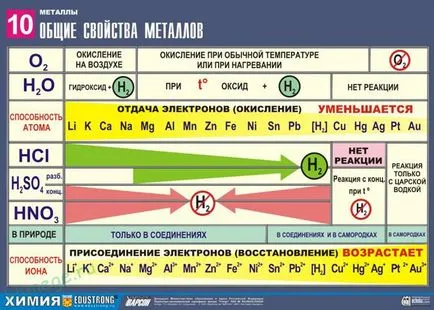
Proprietățile chimice generale ale metalelor
Reducători Strong: Me 0 - Nē → Me n +
Mai multe stres caracterizează activitatea relativă a metalelor în reacții redox în soluții apoase.
1. Reacțiile metalelor cu nemetale
1) oxigen:
2mg + O2 → 2MgO
2) sulf:
Hg + S → HgS
6) cu hidrogen (reacționează numai metale alcaline și alcalino-pământoase):
2Li + H2 → 2LiH
2. Reacțiile metalelor cu acizi
1) Fier, în picioare în seria de tensiune electrochimică la neokisliteli H acid-a redus la hidrogen:
2) de acid-oxidanți:
Prin reacția orice concentrație de acid azotic și acid sulfuric concentrat, de metal niciodată alocat!

3. Interacțiunea metale cu apă
1) active (metale alcaline și alcalino-pământoase) formează baze solubile (alcaline) și hidrogen:
2) media Metalele activitate oxidată cu apă atunci când este încălzit la oxid de:
3) Inactiv (Au, Ag, Pt) - nu reacționează.
4. Ștergeți mai multe metale active, metale mai puțin active din soluții de săruri ale acestora:
În industrie, utilizarea nu este adesea metale pure și amestecuri ale acestora - aliaje. unde proprietățile utile ale metalului sunt completate de alte proprietăți utile. De exemplu, cuprul are duritate scăzută și este de puțin folos pentru fabricarea de piese de mașini, aliaje din cupru cu zinc (alamă) sunt deja suficient de dure și sunt utilizate pe scară largă în inginerie mecanică. Aluminiu are o plasticitate înaltă și ușurință suficientă (densitate scăzută), dar prea moale. Pe baza sa se pregătească un aliaj cu magneziu, cupru și mangan - duraluminiu (duraluminiu), adică, fără a pierde proprietățile benefice ale alumină, duritatea devine ridicată și devine utilă în industria aeronautică. aliaje de fier cu carbon (și alți aditivi metalici) - este cunoscut pe larg fier și oțel.
Metale sub formă liberă sunt agenți de reducere. Cu toate acestea, reactivitatea unor metale este redusă, datorită faptului că acestea sunt acoperite cu pelicula de oxid de suprafață. în diferite grade de rezistență la acțiunea substanțelor chimice, cum ar fi apa, acid și soluții alcaline.
De exemplu, plumbul este întotdeauna acoperit cu un strat de oxid, tranziția la soluția necesită nu numai impactul reactiv (de exemplu, acid azotic diluat), dar, de asemenea, de încălzire. Pelicula de oxid de pe aluminiu împiedică reacția sa cu apa, dar este distrusă de acțiunea acizilor și bazelor. peliculă de oxid friabil (rugină), formată pe suprafața de fier în aer umed nu împiedică oxidarea ulterioară a fierului.
Sub acțiunea acizilor puternici formează o peliculă de oxid stabil pe metale. Acest fenomen se numește pasivare. Astfel, în acid sulfuric concentrat pasivizat (și apoi nu reacționează cu acidul), metale precum Be, Bi, Co, Fe, Mg și Nb, și acid azotic concentrat - A1 metal, Be, Bi, Co, Cr, Fe , Nb, Ni, Pb, Th și U.
Prin reacția cu agenți de oxidare în soluții acide majoritatea metalelor provenite din cationii, taxa este determinată de o stare de oxidare stabilă a elementului în (Na +. Ca 2+, A1 3+, Fe 2+ și Fe 3+)
Activitatea reductivă a metalelor în soluția acidă este transferată aproape tensiuni. Cele mai multe metale se traduce într-o soluție de acid clorhidric și acid sulfuric diluat, dar Cu, Ag și Hg - numai sulfuric (concentrat) și acid azotic, și Pt, și Au - "aqua regia".
coroziunea metalelor
proprietate chimică este indezirabil lor metale corozive, t. E. deteriorare activă (oxidare) la contactul cu apa și sub influența oxigenului dizolvat (coroziunea oxigenului). De exemplu, produsele de coroziune de fier cunoscute pe larg în apă, rezultând o rugină și se năruie într-un produs pulbere.
Coroziunea metalelor apare ca în apă datorită prezenței gazelor CO2 și SO2 dizolvat; Se creează un mediu acid, iar cationii H + sunt deplasate metale active, pentru a forma H2 hidrogen (coroziunea hidrogenului).
Este din cauza acestei suprafețe rugina cutii de conserve de legume (de fier acoperite cu tabla) atunci când stocate într-o atmosferă umedă și lipsit de griji (pauze de fier rapid în jos, după apariția chiar și o mică zgârietură, permițând contactul cu umiditatea de fier) de manipulare. Dimpotrivă, suprafața ruginește fier galvanizat cupe lungi, deoarece nu chiar dacă există zgârieturi coroda fier și zinc (mai mult metal activ decât fierul).
Rezistența la coroziune pentru un anumit metal crește cu acoperire metalică mai activă sau fuziunea acestora; deci, acoperirea de aliaj fier-crom sau de fier de fabricație crom elimină coroziunea fierului. Chrome fier și crom oțel cu conținut (oțel inoxidabil) au o rezistență ridicată la coroziune.