procesele anodic - studopediya
În general, procesul anodic este scris:
În funcție de starea de agregare a proceselor anodice produselor obținute sunt divizate în procese redox fără izolarea unei faze independente, procesele pentru a forma procese solide de evoluție a gazului produs anod, procesează cu un material anod de dizolvare (anozi solubili).
Prin procesul fără izolarea proceselor de auto-faze includ producerea de oxidanți puternici.
soluții alcaline concentrate clorinare cu reacțiile de formare a acidului hipoclorit și hipocloros:
Cl2 + OH - = NS1O + Cl - (3.44)
Hipocloritul suplimentar este oxidat la anod la cloratul:
Un al doilea exemplu de - formarea acidului persulfuric prin oxidarea electrochimică a soluțiilor concentrate de acid sulfuric:
urmată de dimerizarea radicalilor
In mod similar, anodul este pregătit ion permanganat:
La fel ca și în cazul apariției unor astfel de procese la catod, polarizarea anodică este determinată de natura și de concentrare dificultăți în livrarea anodul forma redusă a substanței și retragerea din suprafața formei oxidate a materialului anodului. Distribuția activităților în teaca prezentată în ris.3.9, o curba de polarizare pentru procesele catodică și anodică prezentat în ris.3.10.
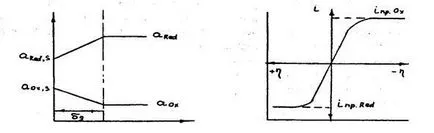
activități Ris.3.9.Raspredelenie Ris.3.10. Type strat de polarizare în curba anodică
Astfel, valoarea de polarizare este asociată cu amplitudinea densității curentului prin ecuația:
Un exemplu de procese la anod pentru a forma produse solide este obtinerea electrolitica MnO2.
Procedeul reduce oxidarea la anod de ioni de mangan bivalent și trivalent la starea tetravalentă:
Mai mult, Mn 4+ ionii sunt obținuți prin disproporționarea ionilor Mn 2+:
2Mn 3+ = Mn 2+ + Mn 4+. (3.52)
Formarea ulterioară a MnO2 se produce din cauza reacțiilor de hidroliză:
Acesta joacă un rol important în această fază a procesului de polarizare.
La densități de curent ridicate, temperaturi scăzute și concentrații de Mn 2+ crește faza de polarizare, rezultând într-un dioxid de mangan cu granulație fină. La densități de curent anodice scăzute, concentrații mai mari de Mn 2+ și temperaturile fazei de polarizare este redusă, ceea ce permite obținerea unui dioxid de mangan grosier.
În același mod au fost preparate PbO2. SnO2, și alte produse.
procese hidrometalurgice larg răspândite cu evoluție de gaz anodic, astfel de procedee pentru producerea clorului prin electroliza soluțiilor apoase de clorură de sodiu, procedee pentru producerea oxigenului în descompunerea electrolitică a apei. Polarizarea în acest caz, de obicei, este faza și fie determinate de dificultățile asociate cu recombinarea atomilor adsorbiți în moleculă, sau formarea și descompunerea pe suprafața compușilor complecși anod. Acest lucru este ilustrat pe curbele de polarizare a materialului anodului (Figura 3.11 și 3.12). Eliberarea oxigenului are loc conform reacțiilor:
în soluții de săruri și baze
în soluții de acizi puternici:
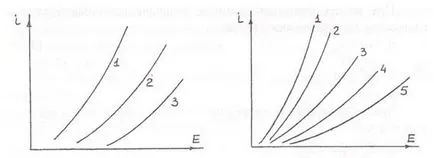
Ris.3.11.Polyarizatsiya anod la anod la Ris.3.12Polyarizatsiya
Alocarea clorului din soluții de NaCl de oxigen evoluție 0,1N KOH
(250g / l) la 80 ° S.Material anod: la 17 ° C Material Anod:
1-Pt; 2-grafit; 3-1 magnetit-Cu; 2-Ni; 3-Ag; 4-grafit; 5-Pt
Cea mai înaltă supratensiune evoluție oxigen valori tipice pentru metalele din grupa platinei, care prezintă valori scăzute ale supratensiunilor de eliberare de hidrogen. dependența de supratensiune de densitatea de curent este caracterul Tafel:
h = a + blgi. (3.57)
Coeficienții a și b variază în funcție de densitatea de curent, din cauza naturii diferite a fazelor intermediare sunt formate. Astfel, un anod de platină pentru a crește densitatea de curent apar formarea secvențială și dezintegrare pe suprafața oxizilor superioare RtO2 instabile. RtO3. RtO4. pas stabilește că valorile directe caracter h-LGI și foarte mari de oxigen evoluție supratensiune ajungând la 1 A / cm2 1,38 V.
Pentru toți electrozii cu degajare de gaz, caracterizat prin așa-numitul „efect de anod“. Ea se manifestă în creșterea bruscă a rezistenței la interfața dintre anod-electrolit, ceea ce duce la o creștere a tensiunii de electroliză la 10-100 V, apariția descărcării scânteie în stratul anod.
Cauzele efectelor anodice sunt ambigue. Acestea pot fi slab efectuarea compus de suprafață de tip CFN. SCln. Etc CBRN
Un alt motiv poate fi o rezistență non-gaz hidrodinamic, care apare atunci când odată cu creșterea densității curentului anodic la produsele gazoase critice nu au timp să se retragă din împresura anod zona de anod. Filmul rezultat are același gaz, în comparație cu electrolitul rezistență substanțial mare și produce efectul de anod. Ultima interpretare este susținută de dependența densității curentului critic a higroscopicitatea anod electrolit. Cu cât umectabilitatea, mai mare Ic.
Anodică de dizolvare a metalului, conform reacției
Me - Me ne = n + (3.58)
însoțite fie o polarizare electrochimică sau concentrare. Cea mai mare parte, de regulă, același tip de polarizare, care este predominantă pentru procesul de catod.
În valoarea de control polarizare electrochimică asociată cu o ecuație Tafel densitatea curentului
Când controlul de difuzie - ecuație polarizare concentrare:
Concentrația ionilor metalici dizolvați în teaca (cs) crește direct proporțional cu creșterea densității de curent, în conformitate cu ecuația
La atingerea limitei de solubilitate a sării de metal în electrolit, la pelicula de suprafață anodică formate săruri solide face dificilă descărcarea produselor de electroliză în volumul de electrolit, crește brusc scăderea rezistenței și tensiunii în electrolit, ceea ce reduce electroliza curent. Acest fenomen se numește „pasivare sare“.
Prin deplasarea potențialului anodului la valori pozitive pentru un număr de metale sunt create condiții pasivare, pentru a forma pe suprafața subțire (2-10 microni), dar pelicula de oxid suficient de dense pasivarea anod, împiedicând trecerea curentului de electroliză și conduce la o polarizare semnificativă a anodului. Acest fenomen este cunoscut sub numele de „oxid de pasivare“ sau pur și simplu „pasivarea anod.“
Un exemplu este dizolvarea anodică a fierului în soluții H2 SO4 (3.13)
Curbele de polarizare Ris.3.13.Vid pentru pasivarea metalelor (Fe în soluții de acid sulfuric) ab - zona de dizolvare activă a fierului pentru a forma Fe 2+. Ef - flyade potențial - electrod potențial de tranziție la starea pasivă, corespunde reacției 2Fe + 3H2O = 6e-Fe2 O3 + 6H +; bg - regiunea statului pasiv (DE); DG - selecție de O2 anod.
Un exemplu de amestec „sare“ și „oxid“ pasivizare este dizolvarea anodică a plumbului în soluții de acid sulfuric (Figura 3.14).
1- dizolvarea regiunii active:
La E = 0,356 În OL RbSO4 atins. apare pasivizare sare (regiunea II).
= 0,615V Când joncțiunea anod este realizată într-o stare pasivă:
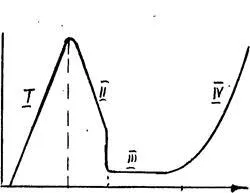
0 0,356 615 E 1,23
Figura 3.14. Type Curbele de polarizare pentru sare și oxid de pasivare (Pb în soluții de acid sulfuric)
Când 1,229 în potențialele evoluție de oxigen obținute prin reacția H2O - 2e = 2H + + 1 / 2O2 (zona 1U).
Deoarece pasivare din cauza aspectului, conferind numărul produsului de proprietăți ale suprafeței metalului o peliculă densă oxid, produsele de proces anodizare utilizate pe scară largă în practica industrială (acoperire rezistentă la căldură anticoroziv, un grund pentru vopsire, acoperiri decorative etc.).
Cu toate acestea, la dizolvarea și rafinarea metalelor, acest fenomen este extrem de nedorit deoarece conduce la o scădere drastică a ratei de dizolvare, polarizarea semnificativă a anodului, ionizarea impuritățile electropozitive, contaminarea metalului catodic. Pentru a reduce impactul negativ al pasivizarea anodului utilizat un număr de tehnici:
1) utilizarea de curent invers pentru a traduce și să mențină anod în potențialul de dizolvare activ (VG Lobanov)
2) superpassivation anod, conducând la formarea oxizilor mai mari sunt ușor solubili în electrolit. De exemplu, la supratensiunile ridicat de oxid de pasivare Cr2 O3 devine bicromatului solubilă, Cr2 O7 2-,
3) introducerea în activatorii de electrolit: CI -. Br -, I -. Și F - și etc.
Activatori adsorbție stramuta de la suprafața agenților electrod pasivare, prevenind astfel pasivizarea anodului.
De exemplu, crom în soluții de acid sulfuric este în starea pasivă și nu interacționează cu ea. Este necesar să se introducă o soluție de clorură de sodiu ca interacțiune rapidă începe crom și acid sulfuric cu evoluția hidrogenului.
Anodică de dizolvare a aliajului (amalgam) este complicată de aliaj de concentrare polarizare:
hspl = - ln. care poate fi calculată din valoarea limită a curentului ionizarea amalgam de metal solut:
Type Curbele de polarizare prezentate în figura 3.15 din amalgam cu diferite concentrații de metale electroactive (x1> x2> x3).
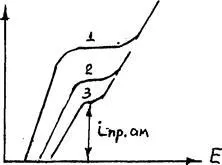
Figura 3.15. Tipul curbelor de polarizare pentru dizolvarea amalgame
În principiu, toate metalele rafinor ar trebui să fie considerate ca aliaje complexe. Inițial componentele electronegative sunt dizolvate din ele. De exemplu, pentru cupru (E ° = 0,337V) este Pb (E o Pb 2+ / Pb = -0,126B), Ni (-0,24 V).
Deoarece concentrația acestor metale este scăzută, dizolvarea lor este la limita de curent cu principalul proces - ionizare a cuprului.
Deoarece stratul de dizolvare de cupru de suprafață îmbogățită în conținutul elementelor electropozitive de aur și argint: Ag (E ° Ag + / Ag = 0,799V), Au (E ° Au + / Au = 1.7V). Când tehnologia potențialelor de ionizare ale acestor metale nu pot fi realizate și se fărâmițează anod prin trecerea suspensiei.
Cu toate acestea, atunci când o polarizare anodică semnificativă (datorită pasivizare sau inp atinge dizolvarea aliaj de cupru), datorită conținutului mare de Ag, Au pot produce ionizarea metale nobile, care sporesc pierderea de cupru de la catod (figura 3.16).
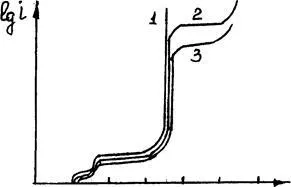
0 0,24 0,48 0,72 0,96 E, B
Figura 3.16. Type Curbele de polarizare cu cupru brut aditivi diferite de argint: 1 - blister din cupru;
2 - blister suplimentat cu 10% Ag; 3-c suplimentat cu 20% Ag
Controlul controlului potențial este tehnologia de conformitate, calitatea controlului de metal, software-ul de control al indicatorilor economici dreapta.