procese circulare
proces ciclic sau ciclu. Acest proces este numit atunci când sistemul trece printr-o serie de stări intermediare, acesta revine la starea sa inițială. Grăitor proces ciclic descris în Fig. 6.8 o curbă închisă compusă din porțiuni de extensie (1A2) și compresiune (2b1).

Pentru a extinde gazul din corp la o temperatură T1. numit de încălzire. raportat cantitatea Q1 de căldură. In timpul comprimării, gazul dă cantitatea de căldură Q2 la T2 temperatura corpului <Т1. называемому холодильником .
În cazul în care ciclul merge în sensul acelor de ceasornic, este numit direct. O expansiune de lucru pozitiv, realizat de gaz și numeric egală cu aria figurii (V1 1a2V2), o mai mare negativ A2 munca de compresie. făcut pe gaz și suprafața figurii exprimată prin (V2 2b1V1). Prin urmare, activitatea A, pentru o formă perfectă ciclu și numeric egală cu suprafața (1a2b1) este pozitiv:
Ciclul direct utilizat în mașini termice - dispozitive care funcționează în mod periodic, care transformă căldura produsă de încălzire, lucrarea lui A.
Din moment ce, ca urmare a procesului de circulare, sistemul este resetat, variația energiei interne în funcție de stat, # 916; U = 0.
Prin urmare, în conformitate cu prima lege a termodinamicii (6.21) pentru procesul ciclic
Având în vedere că Q = Q1 - Q2. avem:
Definirea unui coeficient termic de eficiență a ciclului ca raportul de lucru A pentru a încălzi sistemul rezultat:
Dacă eficiența termică a motorului să fie egală cu 100%?
Ciclul (ris.6.8) poate merge și invers acelor de ceasornic. Apoi, lucrarea lui va fi negativ. Un astfel de ciclu este numit reflux, și este utilizat pentru transferul de mașini vholodilnyh (datorită funcționării forțelor externe) din căldura corpului o temperatură mai mare la temperatura corpului inferior. Procesul de tranziție de la starea 1 la starea 2 este numită reversibil. În cazul în care sistemul revine la starea inițială a oricărui sistem sau în mediu nu există nici o schimbare. Orice proces care nu îndeplinește aceste condiții se numește ireversibilă.
Toate procesele reale sunt ireversibile. Un exemplu este ireversibilitatea procesului de schimb de căldură, în care căldura este transferată de spontan fierbinte la corp rece, deși procesul invers spontană poate avea loc.
Astfel, procesele reversibile - un concept idealizat. Cu toate acestea, studiul lor este important, deoarece multe procese reale în natură și tehnologie aproape reversibil, iar acestea sunt cele mai economice.
Pe baza a doua lege a termodinamicii, Carnot a demonstrat că toate motoarele termice au cea mai mare eficiență a mașinii reversibile. Cel mai economic este un proces ciclic format din două izoterme și două adiabatic (Figura 6.9), denumit ciclul Carnot.
Se poate demonstra că randamentul ciclului Carnot este determinată doar de temperaturile încălzitorului T1 și T2 frigiderului:
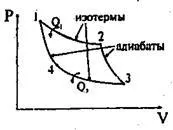
Astfel cum rezultă din (6.47) pentru a crește # 951; necesară pentru a crește diferența de temperatură între T1 și T2 încălzitorului frigiderului.
Formulele (6.46) și (6.47), rezultă că
Luând în considerare faptul că cantitatea de căldură Q2. având în vedere departe un frigider negativ. Apoi, ultima ecuație poate fi scrisă:
Raportul Q / T se numește căldură redusă.
Conferit de căldură Sistemul de încălzire redus cu schimbarea ei este infinitezimal # 948; Q / T. Se poate arăta că pentru orice proces ciclic reversibil având în vedere cantitatea de căldură de la zero. Apoi expresia (6.48), în forma generală poate fi scrisă ca:
Dispariția integrala pe buclă închisă înseamnă că un proces reversibil în integrandul este o diferență totală a unei funcții S, în funcție numai de starea sistemului. S este funcția de entropie.
Formula (6.49), care procesează pentru schimbarea reversibilă a entropiei
Se poate demonstra că procesele neechilibru ireversibile ce au loc într-un sistem închis, entropia crește
Relațiile (6.51) și (6,52) sunt combinate în inegalitatea lui Clausius:
și anume entropia unui sistem închis, fie crește sau rămâne constantă.
Din moment ce procesele reale sunt ireversibile, se poate argumenta că toate procesele dintr-un sistem închis, duce la o creștere a entropiei. Această afirmație se numește principiul creșterii entropiei. Este o altă formulare a doua lege a termodinamicii.
Fizice semnificație Boltzmann entropia găsit, care a arătat că entropia asociată cu probabilitatea termodinamică a stării sistemului. Probabilitatea termodinamica a w este definit ca numărul de moduri în care pot fi puse în aplicare o anumită stare a sistemului. Conform legii Boltzmann, relația S și w este dată de:
unde k - este constanta lui Boltzmann.
Când se ajunge la starea de echilibru a sistemului în această stare, sistemul poate rămâne pe termen nelimitat, și anume Parametrii sistemului nu se schimbă și nu există nici un sistem de fluxurilor de energie sau substanță. În cazul în care fluxurile au loc, schimbarea internă a energiei dU poate avea loc nu numai din cauza mesajelor de sistem de căldură # 948; Q și de a face asupra muncii ei # 948; A, dar, de asemenea, prin transfer de masă. Apoi, prima lege a termodinamicii pot fi scrise într-o formă mai generală
dU = # 948; Q - PDV + # 956; dn,
unde numita energia potențială chimică a sistemului și reprezintă o schimbare pe particulă care participă la transfer când V = const și S = const.
Faza de numita stare de echilibru termodinamic a materiei distinge nu prin compoziția chimică și alte proprietăți fizice ale statelor echilibru ale aceleiași substanțe (de exemplu, apa poate fi în trei faze: lichidă, sub formă solidă și vapori). Tranziția unei substanțe de la o etapă la alta se numește o tranziție de fază.
Distinge tranziții de fază I și tip II. tranziție Faza I fel asociată cu absorbția sau eliberarea de căldură (de exemplu, topire și cristalizare). tranziție de faza II, genul care nu sunt legate de căldură (de exemplu, conversia unor materiale la anumite temperaturi la supraconductor starea cm. Punctul 5.7).
Diagrama de stare utilizată pentru caracterizarea tranzițiilor de fază (coordonate de obicei, P - T). În aceste diagrame, pot găsi un punct de echilibru, simultane trei faze - punctul triplu. De exemplu, punctul triplu al apei 273,16 K. termodinamicii permite calcularea echilibrului dintre cele două faze ale unui material folosind Clapeyron - Clausius:
,
în care derivatul temperaturii de echilibru presiune depinde de căldura tranziției de fază # 955;, temperatura de tranziție și modificarea volumului fazei (de exemplu, atunci când apa îngheață cresc în volum).