Principii de construcție a configurațiilor electronice ale atomilor
Stabilindu orbitali atomici cu electroni se efectuează în conformitate cu principiul de excluziune al lui Pauli, regula și principiul Hund de energie minim.
Principiul Pauli (1925): Atomul nu poate fi doi electroni cu aceleași valori ale tuturor celor patru numere cuantice.
Să ne explicăm acest lucru cu un exemplu. Luați în considerare doi electroni, care sunt la același nivel de energie, prin urmare, ele au aceeași valoare. Apoi, să presupunem că acestea sunt în același subnivele de energie, și anume ele au, de asemenea, la fel. În cele din urmă, cei doi electroni trebuie să fie plasate pe una. și anume valoarea ei același lucru, și de a face acest lucru, ei trebuie să aibă rotiri opuse.
Din principiul lui Pauli conduce la consecințe importante.
Corolar 1. orbital atomic nu poate fi mai mult de doi electroni, în conformitate cu cele două valori ale numărului cuantic de spin.
Corolar 2. Numărul maxim de electroni în acest subnivel:
și anume fiecare subnivel electronic este numărul de electroni egal cu dublul valorii numărului cuantic magnetic.
Deoarece fiecare subnivel cuprinde orbitali (tabel), care pot colonizează numai electron, atunci numărul maxim de electroni la subnivel va fi:
subnivel are. Prin urmare, acesta conține [1];
subnivel are. prin urmare, ea cuprinde;
subnivel are. prin urmare, ea cuprinde;
subnivel are. prin urmare, acesta conține.
Corolar 3. Numărul maxim de electroni la un nivel egal cu de două ori pătratul numărului cuantic principal n:
Această formulă se obține după însumăm numărul de electroni la un anumit de la (Formula Born-Bury):
Ea nu ia în considerare interacțiunea dintre electroni și este valabil pentru.
Gunda regula: In acest sub-strat electronii sunt aranjate astfel încât să se rotească numărul total de ele este maximizată, adică Numai în acest caz, configurația de electroni are cel mai mic de energie. În același timp, trebuie să ne amintim că numărul total de electroni asociat spin este zero. Acest lucru înseamnă că, dacă există un subnivel. acestea sunt localizate după cum urmează:
În caz contrar, spinul total este mai mic de:
Principiul cel mai puțin de energie. Electronii dintr-un atom nu ar trebui să ocupe un nivel mai ridicat de energie atât timp cât există spațiu liber de bază, fiind situat în cazul în care electronii vor avea o energie mai scăzută.
Acest principiu reflectă un model general - stabilitatea maximă a sistemului corespunde la minimum a energiei sale.
Cu toate acestea, în această formulare, principiul cel mai scăzut consumul de energie este foarte dificil. In atomii multi-electron, ca și în stare de electroni atom de hidrogen determinat de valorile acelorași patru numere cuantice, dar în acest caz, electronul este nu numai în domeniul nuclear, cât și în domeniul altor electroni. Prin urmare, având în vedere că energia atomilor multe electroni este determinată nu numai principalul, ci și numărul cuantic orbital, fizicianul sovietic VM Klechkovskaya două reguli au fost dezvoltate într-un secol, va facilita foarte mult sarcina de a pune electroni în atomi:
1. Electronii ocupă mai întâi nivelurile și subnivele pentru care suma numerele de mai jos.
2. Dacă pentru orice sumă de subnivele sunt egale, atunci există o primă umplere a subnivele pentru care numărul este mai puțin importantă.
Energie orbital atomic crește în conformitate cu următorul număr: (fig.)
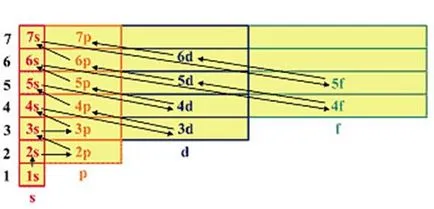
Figura 2.5 - Secvența de umplere orbitali atomice ale electronilor
Luați în considerare umplerea secvențială a cojile de electroni ai atomilor în conformitate cu aceste reguli. formule electronice înregistrate (sau configurații) care reflectă această secvență, prima cifră este. scrisoarea după ce corespunde. iar indicele dreapta sus egal cu numărul de electroni în această stare. De exemplu, formula litiu electronic - Carbon -. clor - populate coji de electroni pot fi reprezentate ca celule cuantice (pătrate sau linii orizontale) (Figura).
Spre deosebire de formulele electronice folosite aici nu sunt două, ci toate cele patru numere cuantice. Se vede că energia electronilor din atomi multi-electron este definit ca numărul cuantic. și; electronii de valori diferite. și la razlichnytolko pereche de electroni rotiri. liber de celule în acest exemplu este liber orbital care poate lua în electronul de excitație al atomului.
Figura 2.6 - Populația cojile de electroni, prezentate sub formă de celule cuantice (pătrate sau linii orizontale)
[1] - desemnarea de electroni.