prelegere alcani
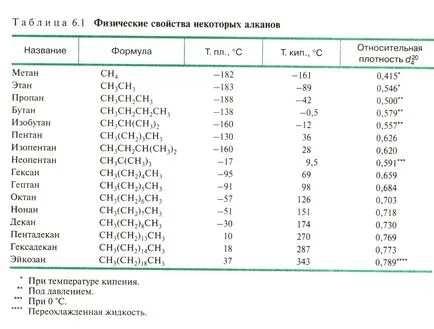
Proprietățile fizice ale alcanilor - vezi tutorialul ..
Metode pentru producerea de alcani
Surse din producția industrială de alcani - gaze naturale, petrol.
Metode sintetice (utilizate în principal în laborator pentru a produce alcani complexe):
1. Hidrogenarea alchenelor și a alchinelor
2. Restaurarea halogenclorură
4. Reacția de Wurtz
5. Reacția Kolbe
Reacția chimică - este de obicei proces cu mai multe etape. Ea începe cu ruperea legăturilor din compușii de pornire, urmată de formarea de noi conexiuni și noi conexiuni. În timpul reacției, intermediarii instabile se formează particule. Secvența de etape ale mecanismului de reacție se numește.
Particula activă - o particulă, având o activitate chimică ridicată, inițiază reacția.
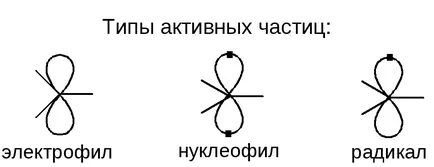
Electrofil - atacuri de electroni ale particulelor în spațiu a crescut densitatea de electroni.
Nucleofil - atacuri ELECTRON particulelor în locuri cu o densitate redusă de electroni.
Radical - particulă electric neutru, atacând legătură nepolar și polar ușor.
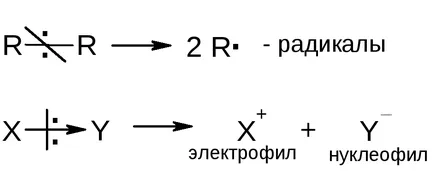
Particulele active pot fi formate prin ruperea legăturii chimice. legături polare Homolytically joase sunt rupte și se formează doi radicali; legăturile polare sunt rupte heterolytically și formate nucleofil și electrofil:
Proprietățile chimice ale alcanilor
Alcani - substanță cea mai inertă chimic.
Legăturii C-C și C-H low-polaritate și rezistent la atacul electrofile și nucleofile, se rup sub acțiunea radicalilor.
Mecanismul de reacție - lanț radical:
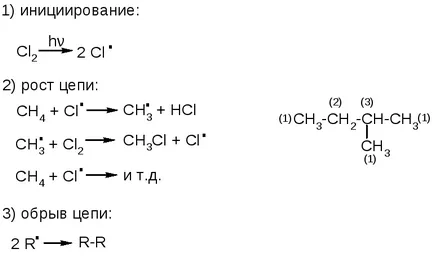
Viteza de reacție a carboni primare, secundare și terțiare este diferită: crește în ordinea: C (1) <С(2) <С(3) (см. предыдущую схему).
Mai mult de clorinare mică selectivă în acest sens, mult mai bromurare selectivă a mai puțin activitatea radical Br.
în faza de vapori la 400-500 °;
fază lichidă - la aproximativ 110-140 (Konovalov)
Alcani - una dintre substanțele oxidate cele mai dificile. La temperatura camerei, ele nu sunt chiar oxidantii puternici.
In combustia alcani sunt transformate în CO2 și H2O
Controlată oxidarea oxigenului la circa 200 și 90 atm. continuă în fază lichidă cu legăturile de scindare C-C și formarea unui amestec de acizi carboxilici.
De exemplu, un procedeu industrial pentru producerea de acid acetic:
3. divizare termică și cracare:
Cracare este foarte larg utilizat în rafinarea petrolului pentru combustibil cu cifră octanică ridicată.
Unii reprezentanți ai alcanilor - vezi tutorialul ..
Cicloalcani - hidrocarburi saturate cu un circuit închis.
Formula generală - -CnH2n (monociclice nesubstituit).
Acestea diferă în cicloalcani:
- Metodă de îmbinare cicluri.
Monociclică. ciclopropan, ciclobutan, ciclopentan, ciclohexan
(Formula explica).
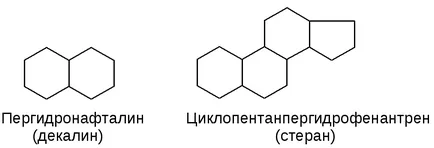
a) condensat (condensat):


tensiuni Teoria (Bayer)
Abaterea unghiul geometric din unghiul de legătură 109 produce o tensiune în ciclul:
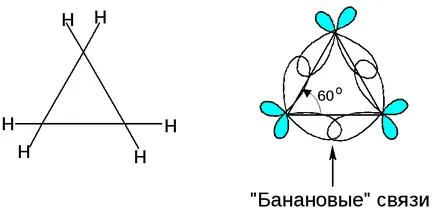
„Banana“ comunicare intermediară de caractere între π- și sigma obligațiuni: nesaturat ciclopropan - cuplare ciclu de reacție cu o pauză.
Metode pentru prepararea cicloalcani
1. dihaloalcani dehidrogenarea (varianta Wurtz de reacție):
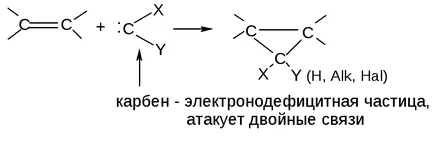
3. Sinteza diena (reacția Diels-Alder):
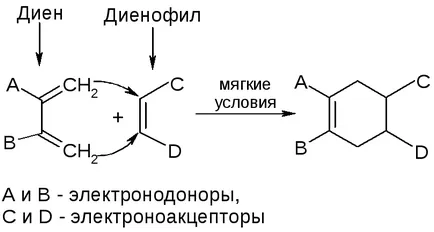
Proprietățile chimice ale cicloalcani
1. Reacții cicluri mici:
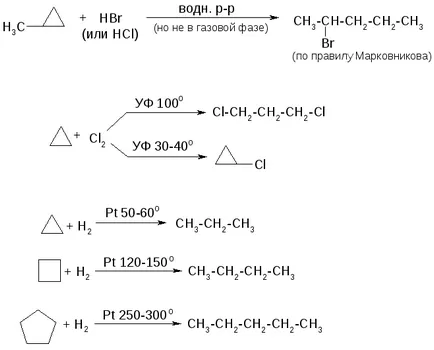
2. Reacțiile de cicluri secundare sunt aproape la fel ca și pentru alcani aciclice.
Unii reprezentanți ai ciclo - a se vedea tutorialul ..