plus electrofilă, substituția electrofilă
Reacțiile electrofilă. Mecanismul de reacție electrofil este un atac nucleofil asupra unui centru electrofil reacționar-TION (N-centru). Ca atare centru în molecula de sub-strat efectuează adesea legătură multiplă (sau atomi de carbon, SP--gibridizovannye), un compus aromatic (benzen) nucleu Deoarece în aceste cazuri există o regiune a crescut densitatea -electron.
Atacarea particulelor - electrofil - poate rezulta fie din comunicare Heterolysis, de exemplu :. sau o polarizare legătură covalentă în apropierea N-centru. În acest ultim caz, se formează un dipol așa-numitul indus (sau REFERIRE) :.
plus electrofil (AE). Există două viespi novnyh mecanism de reacții de adiție electrofili.
1. să fie un mecanism complex. Aceasta cale de reacție se caracterizează în primul rând pe nepolară aderării și substanțelor polare scăzută la compușii care conțin o legătură dublă-ing carbon-carbon. Luați în considerare exemplul unei conexiuni mecanism de reacție a bromului instalația. Îmbogățit cu electroni în centrul de reacție molecula lyarizuet brom, conferindu-i proprietăți electrofile; complex activ este format intermediar - ion bromonievy ciclic. Etapa I este rata de limitare pas protses -SA. Apoi, atac merge rapid particulele nucleofile pe partea opusă (așa-numita antiprisoedi posttratare), din cauza împiedicării sterice din cauza dimensiunii relativ mare a atomului de brom (etapa II). Pentru a re-acțiune caracteristică cataliză acidă, inclusiv cataliză și acru Tami Lewis:
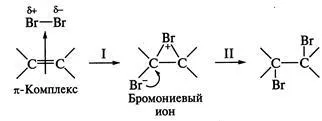
2. carbocationului mecanism. O astfel de traseu de reacție se realizează cu particulele polare aderare (Hhal, și colab.); reacție-limită al-etapă este dublu protonarea a con-comunicare (etapa I) pentru a forma un carbocation cu rapid ulterioară roi de particule atac nucleofil () electron atom de carbon deficient (etapa II)!; de exemplu, adăugarea de HBr:
nestereospetsifichna reacție. Când se alătura halogenurile lor de reactivitate (viteza de reacție) SNI-zhaetsya printre: HI, HBr, HK1, HF.
reacția de hidratare (reacție de adiție de apă) sunt miter-loviyah cataliză acidă. sub formă de acizi în timpul ionilor de ionizare, care au destul de slab nucleofil proprietate-E :. Rezultat protonarea carbocationului nucleofil atacat - molecula de apă - cu educație-niem alkiloksonievogo ion. Ultima stabilizată prin îndepărtarea unui proton, ca rezultat al O-Heterolysis H-PROIS merge „întoarcere catalizator“, reacția este reversibilă. Contactați-rea TION - deshidratarea catalizată de alcooli, acizi:
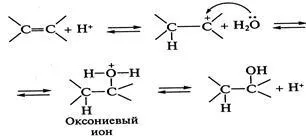
Alkiloksonievogo formarea de ioni este de limitare a vitezei etapa reacției. Mai mult, reacția poate avea loc la π - mecanism complex, în care complexul activat este format în prima etapă:
și care a regizat atacul nucleofil - moleculele de apă.
Luați în considerare două moduri posibile de a adera la bromură de hidrogen la propenă:
atacul electrofil la direcția influențată în principal de doi factori.
1.Pereraspredelenie densitate de electroni -bond Wake-Corolarului efect pozitiv inductiv al (grupul pe termen metale-) mediu:
Preferabil atacă atomul de carbon electrofil cu densitate de electroni rose-shennoy, adică, reacția va continua pe prima cale.
2.Ustoychivost format carbocationilor. Atacul rezultat asupra primului vtorichnyy.karbkation cale este mai stabil decât primar - atacul electrofil produs pe a doua cale. Chiar și o mai mare stabilitate
posedă carbocationilor terțiare.
În consecință, influența acestor doi factori conduce la educarea INJ-2-brompropan (prima cale). Pe scurt, acest mecanism este determinat de regula VV Markovnikov.
Când atașați la alchenele asimetrice polar reactiv HX tip particulă proton electrofil (H +) este atașat la un atom de carbon hidrogenat, iar anionul X - - la mai puțin de atom de carbon hidrogenat la dubla legătură.
Viteza de reacție este influențată de subjets o singură structură m. E. In apropierea mediului centru de reacție. Astfel, substituenții donoare de electroni măresc viteza de reacție, scuti th-ceai aderare (creșterea densității de electroni în centrul de reacție), iar substituenții atrăgători de electroni SNI-zhayut viteza de reacție, ceea ce face dificilă electrofil aderare. Reducerea vitezei de reacție are loc în seria:
Conjugarea crește reactivitatea unei duble legături carbon-carbon, în ceea ce privește electrofile și creșterile respectiv guvernamentale viteza de reacție. Procesul se desfășoară prin etapele succesive conectate pentru a forma un carbocation, deoarece acesta este stabilizat prin delocalizarea încărcare:
Protonare este a doua cale, deoarece în acest ceai SLE format conjugat de tip sistem alilic datorită interacționând atomul de carbon cu deficit reciproc de electroni cu - electroni ai dublei legături:
carbocationului alilic este un agent activ de alchilare electrofil în organismele vii. Delocalizarea densității de electroni în formarea sistemului conjugat determină cele două direcții posibile de atac nucleofil:
Astfel, amestecul de reacție format-produk ing adiție 1,2 (a doua cale) și 1,4-plus (pe-cale vy), compoziția care depinde de condițiile de reacție.
Compușii cu o triplă legătură care conține atomi de carbon într-o stare de hibridizare este, în general mai puțin reactivă în reacții. Rezultând din protonarea carbo-cation - vinilkation - este stabilitatea scăzută. In etapa deprotonare ionii oxonium care rezultă dintr-o deplasare a echilibrului tautomeric (ceto-enol) sunt formate compus oxo (cetonă):
reacții de substituție electrofilă (SE). Pentru compușii aromatici benzen geterotsik veselim și substituția electroni rofilnogo caracteristic răspunsului condensat aromatic cristal.
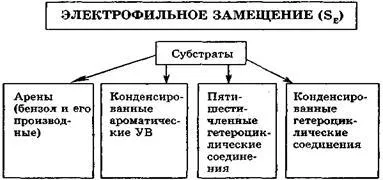
Reacțiile SE Caracteristică este că atacarea reactiv - electrofil - se formează pe reacția din prima etapă, în prezența Lewis acizi (reacție de halogenare, alchilare și acilare prin Friedel-Crafts) sau sub cataliză acidă (alchilarea alchenelor și alcooli, nitrare), de exemplu:
Atacurile de particule au format electrofilă centrului nucleofil - inel de benzen. Ca rezultat al atacului format structură instabilă (-complexul) cu sistem de conjugare circular rupt. Acesta este un pas de limitare (etapa I). Stabilizarea structurii are loc prin clivarea pro-ton -complexul pentru a forma produsul final.
Prin acest mecanism (SE) din sub-straturile enumerate mai sus continua reacția de nitrare, sulfonare, alchilare, halogenare, acilare.
1. Formarea particulelor electrofili - ion nitroniu (NO2 +):
2. Educație π -complexul:
benzen π-complex
3. Educație # 963; -complexul
π - complex # 963; - complex
# 963; -complexul se procedează carbon la starea de hibridizare sp 3, aromaticitate este rupt, complexul este instabil și stabilizarea are loc prin SELECT-sa H +.
4. Formarea nitrobenzen:
5. NSO + H + → H2 SO4 (regenerarea catalizatorului)
Efectul asupra reactivității substituenților în SE
izomeri benzen monosubstituiți au, dar dacă există substituenți pe inelul, simetria inelului naru Schönau prin calcule cuantice sa stabilit că toți substituenții sunt împărțiți în două grupe:
Am un fel de donor de electroni (ED) - cu excepția halogen. Ele cresc densitatea de electroni a inelului, în special în pozițiile orto și para. Acestea includ: OH; -NH2. -CH3. . -O-R; NHR; CI; br; I. Tipul am trimis vice-grupurilor nou sosit în orto și para
Electron genus II (EA); acestea reduc densitatea de electroni a inelului, în special în pozițiile orto și para. Acestea includ substituenți având în partea lui a unei duble legături, ca astfel, există un π-π-conjugare :. . -SO3 H, -NO2; -S≡N; Substituenți genul II este direcționat grup care sosesc în poziția meta
Astfel, la fel ca în cazul reacțiilor asupra ratei de reactivitate și SKO-reacție este influențată de structura substratului, adică. Centrul de reacție Okra tensiune E.. Astfel,-donor de electroni substituenți (+ I-, + efect M) crește densitatea de electroni a nucleului benzenic, rezultând reactivitatea substrat de creștere; electrofil astfel de substituenți sunt orientate în reacțiile în orto -, cuplu poziția (orto și para - orientant sau primul tip trans-orientant). Substituienți electrofili (efect -M) pentru anti reduce densitatea de electroni a nucleului benzenic, care reduce reactivitatea centrului de reacție a substratului; orientate astfel de substituenți electrofil la meta - poziția (meta -orientanty sau al doilea tip orientant).