oxizi de crom - enciclopedie chimică
oxid de crom. În sistemul CrO (Fig.) Există oxizi CrO, SrO2. oxizi de crom Cr2 O3 și colab. Sfântul Island sunt comparate în tabelul. oxid inferior CrO punctul metastabil în compoziția sa sistemul Cr-Cr2 O3 adjudecate pentru a topi exfolierii. la cer se extinde 2-48% at. O. Acest sistem este, de asemenea, a găsit oxid de topire incongruent Cr3 O4. existente la T sus-pax
1550 ° C. El are o structură de spinel distorsionată.
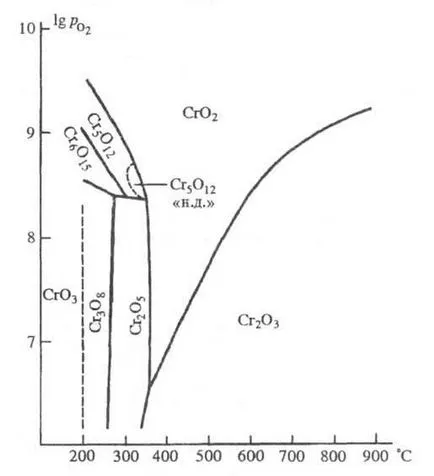
Stabilitate oxizi regiune crom: - presiunea oxigenului (Pa); "ND" - presiune scăzută.
CrO - cristale roșii sau pudră pyrophoric neagră; cristalin. CrO stabilă în aer. nici un sol. în apă. dar oxidează rapid de mai sus
100 ° C. Reacționează cu HK1 pentru a elibera hidrogen gazos. cu dil. HNO3 și H2 SO4 nu interacționează. Ia-CrC convențională termică. descompunere carbonil Cr (CO) 6. Este folosit ca adsorbant pentru purificarea hidrocarburilor din O2.
Hidroxizi Cr (OH) 2 sau galben precipitat brun de săruri p moat de Cr (II) cu alcalii, în absența oxigenului; produs p-rimosti 2,0 x 10 -20; nici un sol. în p-rah alcalii și sa prăbușit. la minut, solubilitate lentă. la sfârșitul anului. la-max; în aer oxidat rapid.
Oxide Cr (III) (sescvioxid) Cr2 O3 (mineral eskolaite) are o structură de tip corindon (formă). Culoarea variază de la verde deschis în materialul fin la aproape negru în cristale mari. Atunci când încălzirea. Verde devine maro reversibil. Acolo amorf Cr2 O3. și structura de tip metastabile kubich.forma spinel (a = 0,836 nm), de culoare brună. Descris ca tetragonal. modificare (a = 0.9480 nm, c = 0.5160 nm) este aparent stabil peste 1000 ° C, Cr2 O3 semnificativ mai volatil
1200 ° C; Se evaporă congruent cu disociere în perechi; -Set ur dependența de temperatură a LGP presiunii vaporilor (.. mm Hg) = 10.62-25300 / T (1504-1821 K); paramagnetic. la 32 K (punctul Neel) devine antiferomagnetism. stat, tranziție de 0,80 kJ / mol; semiconductoare. bandgap
3.4 eV; Mohs duritatea 9.
* Incongruent. ** T. baloturi. 3000 o C.
Cr2 O3 maloaktiven chimic. Nu sol. în apă și org. p-accelerator, care nu a fost interacțiune. p-ramia alcalii. sol. în puternic minute numai pentru încălzire prelungită, este oxidat și trece în p-p prin acțiunea persulfați hot p-Moat sau clorați. și 70% HC1O4. Oxidată se topește KNO3 și KS1O3. interacțiune. se topește cu substanțe alcaline în aer. Când sinterizare cu oxizi metalici sau carbonați formează cromit (vezi. Claudicație). Interacțiunea. cu clor în prezență. carbon la 650-850 ° C superior
1500 ° C, se reduce la un H2 acțiune metal. C, CO, Si, Al, Ca, Mg, și așa mai departe. N.
Ia-Cr2 O3 convențională termică. descompunerea hidroxidului sau hromihromata hidratat (cm. mai jos) CrO3. (NH4) 2 Cr2 O7. bicromaților calcinarea Na sau cărbune K cu Seq. leșiere. Cr din combustie O2. de înaltă frecvență care primesc recomandat hromorg oxidarea oxidului. Conn. de ex. etilbenzolhroma. Cr2 O3 este utilizat pentru a obține blocul metalic. și carburi de crom. ca pigment. catalizator org. sinteza (oxidare. crăpate. Hidrogenarea și dehidrogenare) ca un material de lustruire, componente refractare. Ferite.
Un număr de hidroxizi de Cr (III). Acțiunea asupra sărurilor p ry acvatice Cr (III), format prin gel alcalin sau amoniac precipita Cr (OH) 3 x nh2 O. P hidroxid rimost în apă -7 1-10% în greutate, la 25 ° C Culoarea sa (albastru, verde, negru-verzui sau purpuriu) și Chem. activitate depind de condițiile de depunere. Sol Hydroxide cu ușurință. minerale la minut și bazele p pax. Ca precipitare îmbătrânirea lor scade reactivitate. Când se usucă precipitarea hidrat format din Cr (OH) 3 x ZN2 O la m-ing. B. cristalin obținut. formă; Structura geksagon. (A = 1,230 nm, c = 0,970 nm, z = 8, etc, pe date a = 0,531 nm, c = 0,487 nm.); strâns. 1,64 g / cm 3. Maloustoychiv în timpul depozitării, precum și de încălzire. la
70 ° C într-o continuă amorfă Cr2 O3 hidrat x 5H2 O, rezistent la
85 ° C. Cu deshidratare în continuare preparat hidroxid amorf Cr (OH) 3. Se cristalizează în structura de tip bayerite A1 (OH) 3. geksagon grila. (A = 0.5288 nm, c = 0.4871 nm, z = 2); mai stricte. 2,90 g / cm3; deshidratată aprox. 150 ° C. hidroxid aplicată pentru producerea sărurilor de Cr (III), catalizatori. Ferite.
De asemenea, cunoscut sub numele de hidrat - verde smarald. sau frunziș Guillet, compoziția Cr2 O3 PN2 x O în care n variază de la 1.5 la 2; nici un sol. minerale la minut, baze p pax. solubilitate ușor. în p-rah CrO3. Stabilă în aer. Atunci când încălzirea. la
200 ° C pierde cea mai mare parte a apei (H2O este de 0,5), dar atunci când este expus la aer din nou absoarbe. Complet deshidratat aprox. 600 ° C. A fost preparat prin calcinarea unui amestec de K2 Cr2 O7 H3 BO3 la 500-600 ° C urmat. leșiere. prin încălzire într-un hidroxid de autoclavă Cr cu adaos de boric sau silicic la tine sau reducerea Na2 Cr2 O7 org. în voi (de exemplu. melasă), într-o autoclavă. Aplicat ca pigment.
SrOON oxihidroxid (sau Cr2 O3 x H2O) este cunoscut sub numele de bază Multi. modifikatsiy.Modifikatsiya (Grimaldi mineral) formează cristale de culoare gri-albăstruie, albastru-verde sau maro-roșu; Are romboedrich. Structura (a = 0.2960 nm, c = 1,329 nm, z = 3, grup spațial; .. mai strâns 4,12 g / sm.Modifikatsiya verde (gvianait mineral) are zăbrele rombich (a = 0,4861 nm. b = 0,4292 nm, c = 0.2960 nm, z = 2, spații de grup EPTA). strict 4,57 g / cm 3. a treia modificare (minerale bresuellit) de culoare roșu-brun are rombich structura de tip diaspor. (a = 0,449 nm, b = 0,986 nm, c = 0,297 nm, z = 4, grupul spațial Rbpt). descris smarald verde-modificare, prea ortorombice, structura boehmit tip (spații. grup CMCM). Există indicii existența unei alte, cubică modificãri TION culoare albastru-violet.
Oxo-hidroxid este stabil în aer. practic nu reacționează cu minerale la Tami și alcalii-p ramia. Comportamentul la încălzire. Acesta diferă în diferite versiuni. Obezvozhivanieformy are loc la 370-440 ° C, -modification - la 480-550 ° C, modificări - la 520-570 ° C SYUON formate în timpul deshidratării incompletă de hidroxid de Cr (III). Split. produs în prepararea Cr2 O3.
Dioxid de SrO2 cristalizeaza în structura de tip rutil; pentru datele de gât inel are o regiune de omogenitate (raport A: Cr de la 1,901 la 2,013); feromagnet. Are un bloc de metal. conductivitate; la 110 ° C devine paramagnetic. stat (nici o schimbare în structura). la
510 ° C se descompune Cr2 O3. În aer stabil la fierbere prelungit în disproportionates de apă pe SrOON SrO4 și H2. Sub acțiunea clorhidric la ai oxida cu emisie de C12. Preparată CrO3 SrO2 descompunere sau SR5 Cr3 O8 sau O12 în condiții hidrotermale; care lucrează în mass-media de magneziu. de înregistrare.
Cunoscute paramagnetic amorf. formă SrO2 maro sau negru. Acesta conține urme de apă și, de obicei, ușor mai puțin oxigen; sa f-lu, uneori, scrie CR5 O9 x aq. Când deshidratarea completă descompusă. După cum se poate observa gidroksohromat Dioxid de hidrat [Cr (OH) 2] 2 SrO4. la-ing scade de la p-șanț, conținând Cr (III) și Cr (VI) la pH 3-4; Raze X amorf maro în cantitate, care cuprinde suplimentar 5-5,5 molecule de apă; intermediar în prepararea anumitor compuși de Cr.
gidroksohromaty Descrisă Cr (III) - este Cr (OH) 2 (NSrO4) x 4H2O (când este în picioare cu p set se transformă în SrO2 x 2H2O mama) și SR5 (OH) 9 (SrO4) 3 x PN2 O. Toate acestea sunt amorfi, ușor de sol. într-un dil. la mineral-s si baze p pax. atunci când încălzirea. deshidratate și
250 ° C se descompune. crom Gidroksohromaty (III) total p-ly xSr2 ySrO3 O3 x x O NH2 adesea numită. hromihromatami.
Aceasta indică existența oxizilor SR4 SR6 A7 și A11.
Oxid SR5 O12 - cromatul (VI) crom (III). Evident, o compoziție variabilă de fază a cărei regiune omogenitate se situează în intervalul de compoziții SrO2,4 - SrO2,48 (conform altor date de la SrO2,385 la CrO2,430.). ace negre mici. Nu sol. în apă. sol. într-un dil. la mineral-s; oxid. obținut la presiuni ridicate. conc se descompune. SO4 H2 la reflux. Datele din tabelul. Parametrii structurali sunt neferromagn. Modificarea inalta presiune. Structura feromagnet. (Mai strâns. 3,29 g / cm 3) modificarea de joasă presiune nu a fost studiată.
Oxid Cr2 O5 conține, de asemenea, crom în două stări de oxidare. structural sa f la Cr2 (SrO4) 2 (Cr2 O7). Două modificări descrise - monoclinic cu antiferomagnetism t roi Neel sub 80 K și la presiuni ridicate rombic existente, pentru care se propune f la SR6 O15. Aceste cristale de placă neagră. Ea nu reacționează cu apa și pauză. la-ter, sol. la sfârșitul anului. SO4 H2 la temperatura camerei t-D. S-a obținut prin termică convențională. descompunere Cr3 O8 CrO3 sau O2 în atmosferă (270-300 ° C).
Ca hidrat Cr2 O5 poate fi considerată gidroksodi-cromatul Cr (OH) Cr2 O7 x2N2 La precipitarea din p-moat apos. Este o amorfă brună în cantitate, sol. într-un dil. la minut și alcalii; la 100-160 ° C, este deshidratat la 250-350 ° C se descompune.
Cr3 O8 oxid [sau Cr2 (Cr2 O7) 2 (Cr3 O10) - foarte mici cristale maro inchis; antiferomagnetica. temp Neel
