molecule polare și nepolare - legătura chimică - chimie generală, chimie alocația pentru introducerea
GHID PENTRU CHIMIE CANDIDATULUI în instituțiile de învățământ superior
Partea I. Chimie generală
Secțiunea 3. obligațiuni chimice
§ 3.4. Polar și molecule non-polare
polarizare unilaterala produce o distribuție neuniformă a densității de electroni în moleculă. De exemplu, în HC l densitate molecula de electroni, la miezul de clor este mai mare decât cea a nucleelor de hidrogen. centre electric de sarcini pozitive și negative în moleculă nu coincid la un moment dat, și se află la o distanță de l (fig. 3.12). O molecula cu o neutralitate globală reprezintă un dipol electric cu o sarcină de - q atom y clor și a + q un atom de hidrogen. Astfel de legături și molecule sunt numite polare. Taxe de atomi într-o moleculă numite taxe eficiente q (molecula HC în C l q l = -0.18, n = încărcare absolută 0,18 q
electron comunicație ionicity 18%).
Se măsoară polaritatea moleculei și - momentul electric u, ( „mu“) dipolului determinat de produsul
unde q - sarcina efectivă; l - lungimea dipol.
Conform sistemului internațional de unități electrice valoarea momentului dipol exprimat prin 3,33 • CI • 10 -30 m (Coulomb metri).
Electric dipole moment - o cantitate vector. Direcția de luat în mod convențional de la pozitiv la sarcina negativă - în direcția de deplasare a norului de electroni liant.
momentelor dipol electrice determinate experimental pentru diferite conexiuni și cantități mari de substanțe (acestea au o valoare de la 0 până la 36,6 ∙ de 10 - 30 Cl • m).
Este necesar să se distingă polaritatea moleculelor de polaritatea conexiunii. Pentru molecule diatomice tip AB, aceste concepte sunt aceleași, așa cum se arată în moleculă Exemplul l NA.
In aceste molecule, cu atât mai mare diferența de electronegativitate de elemente, cu atât mai mare moment de dipol electric.
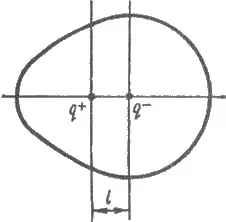
Fig. 3.12. molecula Polar cu un moment de dipol electric permanent
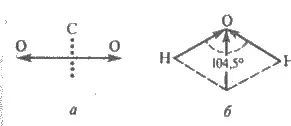
Fig. 3.13. momentelor geometrice adiție conexiunile electrice ale dipolilor în moleculele de CO2 (a) apă și (b)
In moleculele poliatomice, legătura dintre atomii pot fi polare, moleculele ei înșiși și, în funcție de structura sterică poate fi fie polar sau nepolar. dipol momentul electric în moleculele determinate de numărul de legături polare și napryamlenіstyu. El este suma vectorială a momentelor de dipol de obligațiuni individuale. De exemplu, conectarea momentului dipol electric 10 -30 C = O este 9 ∙ ∙ Cl 10 -30 m, iar moleculele de CO2 - zero. Acest lucru se datorează faptului că legăturile cu moleculă vector CO2 liniar dirijat radial din centru, și, prin urmare, ca rezultat momentul receptorilor p este zero (fig. 3.13, a). In legătura molecula colț H2O are un unghi de 104,5 ° și suma vectorială a celor două legături este exprimată printr-o diagonala paralelogramului (plus vectorul se realizează conform regulii paralelogramului forțelor, Fig. 3.13, b). Pentru apa μ = • 10 -30 6,1 Cl ∙ m. În cazul în care rezultă vectori geometrici diverse momente de dipol electric nu este zero, molecula polară.
La rândul său, valoarea și direcția μ poate fi considerată într-o anumită măsură, pe structura geometrică a moleculei. De exemplu, pentru moleculele de SO 2 μ = 5,4 ∙ Cl • 10 -30 m. Evident, este ca o moleculă de apă, trebuie să aibă o structură unghiulară.
Molecule care conțin o legătură covalentă nepolară sunt numite non-polare sau homopolar. Legarea unor astfel de molecule sunt distribuite simetric nor de electroni între nucleele celor doi atomi și nuclei la fel actioneaza pe ea. Un exemplu poate fi un simplu substanțe cu moleculă constând din atomi de un singur element: H2. F 2. C l 2. B2 etc. dipol electric moment de molecule este zero. După cum sa menționat, multe sunt molecule nepolare construite simetric compuși complecși, deși legătura dintre atomii polari în acesta. Substanțele cu non-polare legătură covalentă un pic.
Capacitatea moleculelor (și legături individuale) polarizat de un câmp electric extern numit polyarizovanіstyu. Acest lucru se poate produce sub influența câmpului generat de molecula polară se apropie. De aceea polyarizovanіst este important în reacții chimice.
Este întotdeauna important să se ia în considerare polaritatea moleculei și momentul său de dipol electric. Ostannіmzumovlena Substanțe reactivitate. In general, cu cât dipol momentul electric al moleculei, cu cât reactivitatea compusului. Cu un moment de dipol electric, acesta este, de asemenea, substanțe și solubilitate aferente.
Moleculele polare contribuie la disocierea electrolitică a electroliților dizolvate în ele.