Metode de studiu a proceselor termodinamice

Acasă | Despre noi | feedback-ul
In studiul tuturor proceselor sunt considerate ca fiind egale cu arcuri și reversibile.
Înainte de a examina procedura pentru studiul proceselor termodinamice, introducem starea parametru al cincilea al gazului - entropie S. Entropy caracterizează direcția de curgere a schimbului de căldură între sistem și mediul extern.
Pentru o masă de gaz arbitrar G (kg) de entropie S măsurată în kJ / K și 1 kg de entropie a gazului desemnat prin litera s și măsurată în kJ / (kg • K), adică în aceleași unități ca și capacitatea de căldură în masă.
În termodinamică, variația de entropie este determinată numai # 916; = S S - S. În acest sens, în mod convențional că la 0 ° C, și la orice presiune entropia S, precum și energia internă, și este egală cu zero.
Fără ajutorul matematici superioare, pentru pro-freestyle (politropic) proces termodinamic poate fi scris:
unde # 916; Q - cantitatea de căldură implicată în orice proces termodinamic elementar, kJ / kg;
# 916; S - schimbare de entropie în acest proces elementar, kJ / (kg # 8729; K).
atitudine # 916; q / T se numește căldură redusă și reprezintă o caracteristică calitativă a căldurii procesului de conversie.
Schimbarea entropiei ca o funcție de stat nu depinde de calea de curgere de proces (adică tranziția fluidului de lucru), iar stările inițiale și finale,
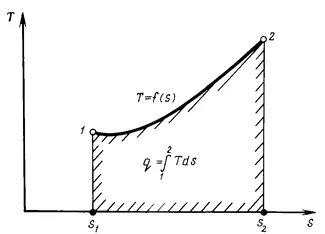
Introducerea conceptului de entropie ca parametru de stare Rabo care organismul permite să se aplice pentru a studia termodinamice-ically noi procese (pv-diagrama introdus mai devreme), sistem, s, în care abscisa la scara corespunzătoare pune entropie s, iar axial direct de coordonate cărbune-T ordonata - temperatura absolută T. Această diagramă se numește INDICA-Ts-diagrama (Figura 1.6.).
În această diagramă, zona delimitată per - set, coborât pe abscisă punctelor statelor inițiale și finale, iar abscisa exprimă numărul raportat sau retragerea căldură q. De aceea, diagrama TS este, de asemenea, numit termică sau entropie. La fel ca în ecuația (1.54), temperatura T - valoarea este întotdeauna pozitiv TION, # 916; s și # 916; q au același semn, și anume, q dacă căldura este furnizată de gaz (valoare pozitivă), atunci # 916; S crește. Pe de altă parte, în cazul în care # 916; Q este dat (valoare negativă), atunci # 916; S scade. Aceasta este una dintre cele mai importante proprietăți ale entropiei.
definite de lyayut în studiul proceselor termodinamice:
1) ecuația procesului și imaginea sa grafică în sistemul de coordonate al p, v,
2) relația dintre parametrii principali ai stare a gazului;
3) modificarea energiei interne a gazului # 916; u și valoarea lucrărilor de expansiune l;
4) Cantitatea de căldură q, transmisă la gaz sau retrase din acesta;
5) Procesul de imagine în sistemul de coordonate T, s.
Procesul are loc la volum constant se numește izocoră. proces izocoră se aplică, în special, atunci când se calculează cicluri teoretice MOTOR teley carburator a motorului cu ardere internă (ICE). ecuaţia procesului
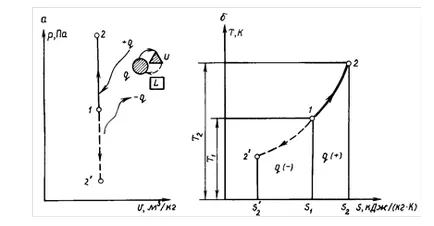
In pv-anagram (Fig. 1.7), graficul de proces este o linie dreaptă perpendiculară pe abscisă și numit isochore.
La volum constant # 916; # 965; = 0 zona corespunzătoare # 961; # 965; -diagram expansiune l. De asemenea, este zero. Prin urmare, în procesul de lucru izocoră de expansiune a gazelor l = 0.
Relația dintre parametrii determinați schimbarea gazului din ecuația (1.13), înregistrate pentru l inițiale și finale 2 (a se vedea figura 1.7, a ..) Statele:
Împărțind termenul de termen, obținem
Ecuația (1.56) arată că presiunea gazului de proces izocoră este direct proporțională cu absolut tempera-rotund.
Deoarece în procesul l = 0, atunci conform ecuației (1.48), fluidul de lucru furnizat căldura q complet consumată în schimbarea energiei interne:
In 1-2 proces „(vezi. Fig. 1.7, a) căldura q îndepărtat din gaz, reducând astfel temperatura. În consecință, procesul 1 - 2 „- răcirea fluidului de lucru (- q).
Schimbarea entropiei specifice # 916; = S S - S. în procesul izocoră (capacitate termică la constantă C), numărate de formula
unde # 916; S - schimbarea de entropie a gazului, kJ / (kg • K); C - capacitatea medie termică a masei de gaz în proces când v = idem; T. T; este temperatura la începutul și sfârșitul procesului, K.
Ecuația (1.59) arată că procesul izocoră este reprezentat în coordonatele T, s curba logaritmică (a se vedea figura 1.7, b ..) Și curge, astfel încât căldura de intrare (+ q) crește entropia și temperatura gazului și la îndepărtarea căldurii (- q), acest parametru scade.
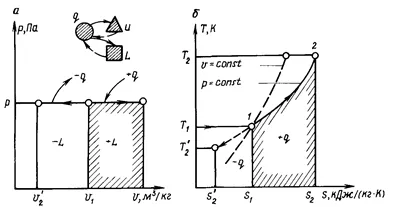
Procesul de curgere la presiune constantă numită izobară. Un astfel de proces poate prezenta termodinamice-tech în cilindru, pistonul care este deplasat, fără frecare, astfel încât presiunea din cilindru este constantă și egală cu presiunea din pistonul mediului înconjurător.
(. Figura 1.8) în pv-diagrama izobară este o linie dreaptă paralelă cu axa x (axa volumelor specifice v):
1 - 2 - cu sursa de căldură (+ q), și 1 - 2 „- cu îndepărtarea căldurii
Relația dintre valorile principalelor variabile
parametrii stării fluidului de lucru este determinat din ecuația Clapeyron (1.13), înregistrate pentru punctele 1 și 2:
Astfel, prin creșterea volumului specific al gazului în procesul izobară, temperatura acestuia crește, pe o abilitate-shenii - scade.
munca de expansiune a gazelor l (.. vezi figura 1.8, a) reprezentat de aria de sub linia de proces 1 - 2 - dilatare (+ l) și pentru linia 1 - 2 „- compresiune (- l). Fig. 1.8, și este clar că activitatea de expansiune poate fi determinată prin ecuația
În cazul în care cantitatea de gaz pentru a desemna G (kg), formula de calcul a activității de expansiune devine L
Având în formula (1.63), diferența dintre T temperaturi absolute - T = 1 K, obținem că l = R. Acest lucru face posibilă determinarea sensul fizic al constantei de gaz specific ca activitatea de expansiune a 1 kg de un gaz ideal, atunci când este încălzit la 1 K p = idem.
Schimbarea energiei interne a unui gaz ideal, la o temperatură valori bine-cunoscut-TION la început (T) și de capăt (T) protses-CA (presupunând constantă specifică de căldură C) este exprimată prin ecuația-niem
Cantitatea de căldură comunicată de către fluidul de lucru în proces se determină din expresia matematică termodinamic prima lege (1.48) cu ecuațiile (1.63) și (1,65):
ca și în conformitate cu formula (1.30) C = + R.
Schimbati entropia specifică în procesul izobară sub-citit de ecuația
proces consecință, Ts-diagrama izobarice, precum și izocoră reprezentată curba logaritmică, dar mai mici comparativ cu isochore (vezi. fig. 1.8, b). O astfel de izobară relativă locație și isochore în diagrama Ts- datorită faptului că căldura specifică C>.
Cantitatea de căldură q descrie grafic proces zona Xia (a se vedea figura 1.8, b ..) definită printr-un proces de curbă (1 - februarie un-2 „) și axa abscisă.
In procesele asociate cu calculul centrale, turbine cu abur, precum uscarea și parametrul de producție economică răcire rural utilizată de lucru stare fluidă (gaz), numit entalpie - teplosoderzha-niem. entalpia specifică notată cu h și se măsoară în kJ / kg. Introducerea conceptului de „entalpie“, în plus față de discutat anterior (presiunea, volumul specific, tempera-tur, energia internă, entropia) p, v, T, u, s facilitează studiul proceselor în motoarele termice, în special în turbinele cu abur.
Această stare setare este
Dacă în (1,68) și pv substitut și valorile lor, și anume T = c și pv = RT, obținem
De aceea, entalpia gazului ideal este numeric egală cu produsul dintre căldura specifică la diviziune în masă pentru a preveni constantă de temperatura absolută. Conceptul de „entalpie“ poate da următoarea explicație. Să presupunem că în cilindrul sub pistonul este de 1 kg de gaz. Pune pe masa de încărcare pistonului superior G, o echilibrare a presiunii gazului p.
unde F - suprafața pistonului.
Întregul sistem este în echilibru. În acest caz, energia sistemului (1 kg de gaz și sarcina) este egală cu energia internă și gazul și energia potențială a unei mase de G, ridicat la o înălțime H, egală cu înălțimea cilindrului:
Deoarece FH = u (adică, 1 kg de volum de gaz din cilindru), energia totală a sistemului și este egală cu + pV = h - cea mai mare entalpie de gaz.
Calculul termic este de obicei necesar să se cunoască schimbarea entalpie
(# 916; h = h - h), mai degrabă decât valoarea absolută. Prin urmare, originea
(0 K sau 0 ° C) pentru rezultatul final (# 916; h) nu contează.
Folosind ecuația (1.48) este ușor de a arăta că pentru orice gaz în proces la presiune constantă (izobară, p = idem) de intrare de căldură este egal cu diferența de entalpie la sfârșitul și începutul procesului:
sau în conformitate cu (1,68)
În consecință, în cantitatea izobară proces însumate de căldură clorhidric determinată de diferența de entalpie de capăt (h) și începutul (h) a procedeului.