metale alcaline Acțiune
01 februarie Fe 0 - Fe → Fe f2E proces de oxidare +2 0 - reducator
02 ianuarie 2H + + 2e → H2 0 procesul de recuperare a H + - oxidant
Fe + 2H + → Fe2 + + H2
EMF = 0 - (-0.44) = 0,44
Acid sulfuric concentrat se dizolvă metalele situate în tensiunile rând de argint metalic (inclusiv). aur și platină elemente insolubile (Pt, Os, Ru, Ir, Rh, Pd).
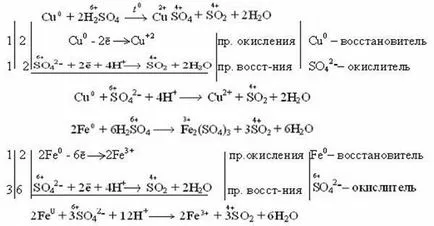
Agentul de oxidare, în acest caz, sulful este în starea de oxidare 6, care, în funcție de activitatea metalului și condițiile (concentrația de acid, temperatura) poate fi redus la 4 sulf, 0, -2. Astfel, produsele de recuperare a sulfului acid sulfuric poate fi
De exemplu: metalele inactive și mai puțin active (Cu, Ag, Fe, Ni) sulf redus la sulf +6 4 (SO2). Reacția are loc prin încălzire.
După cum se vede din reacțiile de acid sulfuric diluat pentru a oxida fierul la +2 și concentrat până la +3.
metale mai activ este redus la 6 sulf fără sulf (S 0) și hidrogen sulfurat (H2S), care are un grad de oxidare sulf -2.
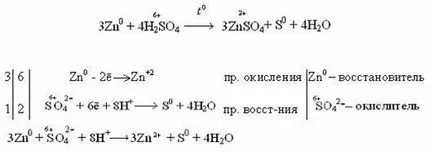
Acțiunea acidului azotic asupra metalelor
Acid azotic, fiind un agent oxidant puternic, acționează la aproape toate metalele (cu excepția Au, Pt, Ru, Rh, Ir, Os, Ta), transformându-le în nitrați, iar unii - în oxizi (metale pasivare).
Particularitatea acțiunii acidului azotic asupra metalelor este că oxidează metalele chiar și fără degajare de hidrogen din soluția acidă diluată, în contrast cu acid sulfuric. Reducerea adâncimii azotului din acidul azotic depinde de concentrația și activitatea din urmă interacționează cu metalul. Acidul mai diluat și mai activă a metalului, cu atât mai mare este recuperarea. Azot Acid recuperat
ÜRazberem câteva exemple de acid azotic cu metale.
Cand interactioneaza cu metale concentrate azotnoykisloty inactive NO2 eliberate:
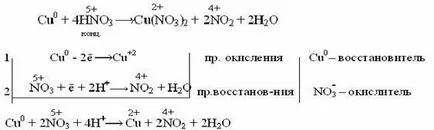
Acidul azotic diluat cu metale mai puțin active și inactive (Pb, Cu, Ni, Ag, Fe) formează NO:
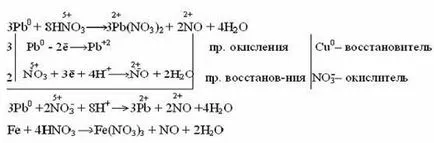
Foarte acid azotic diluat este redus la amoniac (NH3) prin reacția cu un metal foarte activ care se formează în acid medii de ioni de amoniu NH4 +:
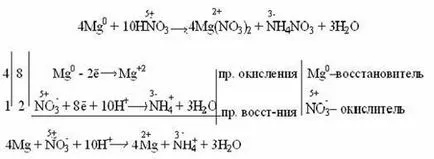
acid concentrat unele metale oferă protecție (Al, Cr, Fe), rezultând în acoperirea de oxid metalic film subțire:
Prin urmare, acidul azotic concentrat sunt transportate în recipiente de aluminiu și se diluează - un rezervor de oțel rezistent la acizi.
Metalele se pot deplasa reciproc din soluțiile de sare. Posibilitatea unor astfel de reacții este determinată prin trecerea poziția metalului în seria electrochimică: mai stramuta metale mai puțin active din soluții ale sărurilor lor.