Măsurarea potențialului de electrod

Acasă | Despre noi | feedback-ul
Nu există în prezent nici o metodă pentru a măsura valoarea absolută a potențialului electrodului individual, ci poate fi determinată prin valoarea cantitativă convențională a potențialului de electrod în raport cu oricare alt electrod care este selectat ca electrodul de referință.
Deoarece electrodul de referință a fost selectat și este utilizat acum electrod standard de hidrogen.
Un astfel de electrod cuprinde o folie de platină imersat într-o soluție care conține ioni de hidrogen și care este spălat în mod constant de hidrogen gazos. hidrogen gazos are 1 Atmosfera de presiune și activitatea ionilor de hidrogen în soluție este de 1 ((uproschenno- când concentrația = 1).
Următoarea reacție are loc pe electrodul de hidrogen:
1, o soluție care conține ioni H + (aH + = 1)
2- cheie electrolitice (punte de sare)
3 Potențialul electrodului este măsurat,
4- cheie electrolitică (tub cu soluția de electrolit)
Potențialul electrodului este EMF celulei, care constă dintr-un anumit electrod și un electrod standard de hidrogen
Dacă-l utilizați în mod corespunzător, electrodul pH-ul poate da rezultate foarte precise, reproductibile la 0.00001V. Dar sensibilitatea mare (dependență) la condițiile externe împiedică puternic utilizarea sa, prin urmare, un alt electrod este mai stabil, cu un potențial de electrod exact cunoscut este utilizat ca referință în locul electrodului de hidrogen. Una dintre cele mai comune - electrod clor-argint, care este un fir de argint acoperit cu AgCl și imersat într-o soluție de KCl (de obicei - saturate).
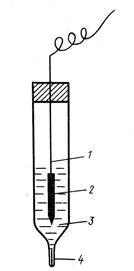
1- sârmă de argint,
2 - clorură de argint,
4 - Tasta electrolitica (capilare umplute cu un inert poros
substanță impregnat cu soluție KCl)
Celula este format din 2 părți, din care fiecare cuprinde un electrod. Schimbarea una dintre piesele, puteți crea o foarte diferite celule galvanice.
forța electromotoare a celulei electrochimice (forță electromotoare) este valoarea maximă a diferenței de potențial dintre electrozi:
În cazul în care sunt jc - potențial catodic,
ja - potențialul anodului.
Oxidarea are loc la anod și recuperarea - la catod.
EXEMPLU înregistrare celulă electrochimică ce cuprinde un electrod într-o soluție de electrod de Zn și Cu ZnSO4 CuSO4 în soluție:
(-) Zn çZn2 + ççcu 2+ çCu (+)
(-) Zn çZnSO4 ççCuSO4 çCu (+)
Zn çZn 2+ este un potențial salt la limita soluției de ioni de metal-metal
ZnSO4 ççCuSO4 prezintă un potențial de electrod difuz salt între cele două soluții.
potențial de difuzie este diferența de potențial care rezultă la interfața dintre cele 2 soluții diferite în formă sau solut dacă la concentrația sa.
Celula maximă de lucru util. La efectuarea reacției reversibile a oricărui trecere la temperatură constantă și presiune obținută din aceasta va funcționa munca de reacție maximă A'max. Lucrarea făcută de un element galvanic în aceste condiții, este elementul EDS, înmulțită cu cantitatea de energie electrică a trecut. Vom exprima cantitatea de substanțe care sunt supuse unor transformări, ca urmare a reacțiilor în unități de atomi-gram de elemente (sau gram-ion ioni complecși). Cantitatea de energie electrică, care corespunde unei astfel de conversie (c-c-atom sau ion) este egal cu NE coulombi × F
Unde sunt NE - taxa de ioni,
F = 96,487 coulomb / mol (sau Kd × mol -1) - constant (întreg) Faraday
(Sens fizic al Faraday - taxa 1gramm atom (sau ioni) substanță).
în cazul în care W'max - lucrare de desemnare în electrochimie.
b × B + d × D Û q × Q + r × R
E = - = = E o - ln
E = E o - ln - Nernst ecuație.
E o - EMF celulei în condiții standard, atunci când Cb = cD = Cq = cR = 1
Valoarea E O - numită normală (sau standard) Element EMF.
Dacă luăm celula electrochimică cu un potențial standard de electrod de hidrogen, atunci electrodul metalic este egal cu: j = j o + lncM
Unde sunt j o - standard, un potențial de electrod - potențial adică care are loc atunci când activitatea (concentrația) a ionilor metalici este egal cu unitatea.
Se calculează potențialul de electrod de diferite metale în soluții saline cu concentrații diferite este posibilă folosind ecuația și valorile potențialelor de electrod standard de metale care pot fi găsite în manualele de Nernst.
Potențialele de electrod standard de diferite electrozi pot fi aranjate într-un interval de așa-numitul stres - seria electrochimică de activitate a metalelor (număr de potențiale de electrod standard,) - secvența în care metalele sunt aranjate în ordinea crescătoare a potențialului lor standard electrochimice # 966; 0. corespunzător jumătate de reacție de reducere a unui cation de metal Me n +:
Me n + + n # 275; → Me
Mai multe stres caracterizează activitatea relativă a metalelor în reacții redox în soluții apoase.
În Uniunea Internațională IUPAC (Uniunea Chimie Pură și Aplicată) a presupus că potențialul de metale, care în raport cu electrodul de hidrogen standard este negativ, sunt scrise cu un „minus“, înainte de valoarea lor. Dacă metalul în raport cu electrodul standard de hidrogen - este pozitiv, valoarea sa este înregistrată cu semnul plus.
Polarizare - o deviere de electrod Potențialele de la valoarea de echilibru, atunci când un curent electric. Polarizare reduce EMF celulei și rata de electroliză.
Concentrarea polarizare se produce datorită modificărilor concentrației de ioni în apropierea suprafeței electrodului prin reacția electrochimică:
Concentrația ionilor de Zn 2+ crește
Concentrația ionilor de Cu 2+ este redusă
polarizarea chimică se produce ca urmare a unei schimbări de stare (natura) a suprafeței electrodului sub influența produșilor de reacție electrochimice (formarea de substanțe la suprafața electrodului, care împiedică reacția electrochimică):
2H + + 2e ® H2 - (acoperă suprafața electrodului)
Reacția poate fi o schimbare electrod metalic la „hidrogen“ (de exemplu, un electrod de cupru poate fi „convertit“ într-un atom de hidrogen)
Dj = j o H2 - j o Cu = - 0,337 V
Ambele tipuri de polarizare pot fi reduse prin diverse metode care sunt numite depolarizare.
Polarizarea de concentrație poate fi redusă semnificativ prin soluție intensivă agitare. polarizare chimică poate fi redusă prin adăugarea de substanțe care vor reacționa cu acele substanțe care au provocat polarizare. De exemplu, ca depolarizer pentru reacție, rezultând gazul de hidrogen este eliberat, este posibil să se aplice peroxid de hidrogen și de a reduce depolarizare: