Masa unui atom
atom în masă. greutate atomică
sectiunea Materiale va ajuta să aflați:
> Care este diferența dintre masa atomului și masa atomică relativă;
> De ce este convenabil să se utilizeze masa atomică relativă;
> În cazul în care pentru a găsi masa atomica relativa a elementului.
Masa de electroni este de aproximativ 9 • 10 -28 g
Caracteristica importantă este greutatea sa atomică. Aproape întreaga masă a atomului este concentrată în nucleu. Electronii au atât de puțin în masă, care este de obicei neglijată.
Se cântărește cântare atomii imposibil, deoarece acestea sunt extrem de mici. masele lor au fost determinate prin calcul.
Masa atomică a Uranus - cele mai grele dintre toți atomii de care se găsesc pe Pământ este de aproximativ
000 000 000 0,000 000 000 000 4 g
Valoarea exactă a masei unui atom de uraniu - 3952 • 10 -22 g, iar atomul de hidrogen, cel mai usor dintre atomii, - 1.673 • 10 -24 g
Operarea cu numere foarte mici inconfortabil. De aceea, în loc de masele atomice „absolute“ sunt utilizate, greutatea lor relativă.
Masa atomică relativă.
Pe masa oricărui atom poate fi judecat prin compararea cu greutatea altor atomi. Anterior, comparațiile au cel mai ușor atom - atom de hidrogen. Acum, masa atomilor
1 Detalii privind evidența acestor numere, veți învăța lecțiile de algebra în liceu.
Inainte de 1961 masa atomica comparativ cu 1/16 din masa atomului de oxigen.
comparativ cu 1/12 - atom de masa Carbo (este de aproape 12 ori mai greu atom de hidrogen). Această masă mică numită unitate de masă atomică (abreviat - ae m ...):
1a. e. m. = 1 / 12mA (C) = 1/12 • 1,994 • 10 -23 g = 1.662 • 10 -24 g
atom de hidrogen in greutate este aproape egal cu unitatea de masă atomică: ma (H)
1a. e. m. Masa atomilor de uraniu în mare ei
Numărul care se obține prin împărțirea atomului elementului de masă la unitatea de masă atomică, numită elementul relativ masă atomică. Această valoare este desemnată A r (E):
Index langa litera A - prima literă din relativus latinescul - relativă.
Relativ element de masă atomică indică de câte ori greutatea atomului elementului este mai mare decât 1/12 atomului Carbo în masă.
Elementul relativ de masă atomică are dimensiune.
Primul tabel de masă atomică relativă în urmă cu aproape 200 de ani de către om de știință britanic John. Dalton.
concluzii pot fi făcute pe baza materialului de mai sus:
• relativă masă atomică proporțională cu masele atomilor;
• raportul masic dintre atomi sunt aceleași ca și masa atomică relativă.
Valorile maselor relative atomice ale elementelor chimice sunt înregistrate în sistemul periodic.
Dzhon Dalton (1766- 1844)

fizicianul englez Eminent și chimist. Membru al Societății Regale din Londra (British Academy de Științe). Emis ipoteza întâi diferite dimensiuni și mase ale atomilor, masa atomică a identificat mai multe elemente relative, constituind primul tabel de valori (1803). Elemente de simboluri propuse și simboluri ale compușilor chimici.
Având mai mult de 200.000 de observații meteorologice prin examinarea structurii și proprietăților aerului, parțiala a deschis legile de presiune (parțială) a gazelor (1801), dilatarea termică a gazului (1802), solubilitatea gazelor în lichide (1803).
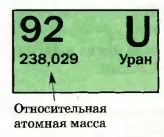
Fig. 35. Elementul de celule uraniu
Acestea sunt definite cu precizie foarte mare; Numerele corespunzătoare sunt, practic, cu cinci și șase cifre (Fig. 35).
În calculele chimice convenționale de valori ale maselor atomice relative luate rotunjire la întregi. Deci, pentru hidrogen și Uranus
Numai masa atomică relativă a clorului este rotunjit la o zecimală:
► Localizați în valorile periodice ale masei atomice relative de litiu, carbon, oxigen, neon, și rotunjirea ei la număr întreg de numere.
► De câte ori masa atomilor Carbo cu oxigen, neon și magneziu mai mare decât masa unui atom de heliu? Pentru calcule utilizând valorile rotunjite ale maselor atomice relative.
Notă. Elementele periodicheskoy sunt introduse în sistem, în ordinea crescătoare a masei atomice.
Atomii sunt în masă extrem de mici.
Pentru comoditatea de calcul folosind masa atomică relativă.
Elementul relativ masă atomică este raportul atomului elementului de masă la - atom Carbo masa.
Valorile maselor atomice relative sunt prezentate în tabelul periodic al elementelor chimice.
?
48. Care este diferența dintre noțiunile de „masă atomică“ și masa atomică relativă „?
49. Care este unitatea de masă atomică?
50. Care este sensul înregistrării Ar și Ar?
51. Care atom este mai ușor - sau titan Carbo? De câte ori?
52. Ce are o masă mare: atom fluoren sau doi atomi de litiu; Magneziul doi atomi sau trei atomi de sulf?
53. Găsiți sistemul periodic de trei sau patru perechi de elemente care poartă atomi de funingine în masă, care este: a) 1. 2; b) 1. 3.
54. Calculați masa atomică relativă de heliu, în cazul în care masa unui atom acelui element este 6.647-10 -24 g
55. Calculați masa atomului de beriliu.
Dacă aveți corecturi sau sugestii la această lecție, vă rugăm să ne contactați.
Dacă doriți să vedeți alte ajustări și sugestii pentru lecții, uita-te aici - Forumul Educațional.