legătură peptidică - studopediya
Aminoacizii din catena polipeptidică sunt legate printr-o legătură amidică este formată între # 945; grupare carboxil a unuia și # 945; gruparea amino a următorului aminoacid (figura 1.). Formate între aminoacizii legătură covalentă se numește o legătură peptidică. Oxigen și gruparea peptidică hidrogen ocupă astfel trans.
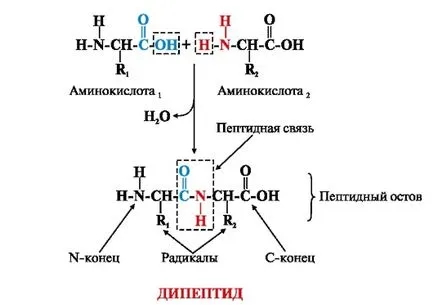
Fig. 1. Schema de peptide svyazi.V fiecare proteină sau peptidă poate fi identificată: N-terminal al proteinei sau peptidei având o grupare amino liberă (-NH2);
C-terminal având o grupare carboxil liberă (-COOH);
peptida Ostovbelkov constând din unitățile repetative: -NH-CH-CO-; Radicalii de aminoacizi (catene laterale) (R1 și R2) - variabile de grup.
lanț stenografie polipeptidic, precum și sinteza proteinelor în celule în mod necesar începe cu N-end și C-terminale:
Denumirile aminoacizilor incluși în peptide și formarea unei legături peptidice sunt de închidere il. De exemplu, tripeptida de mai sus, numit treonil-histidil-prolină.
Singura parte variabilă a distinge o proteină de toate celelalte, este combinația dintre radicalii (lanțuri laterale) ale aminoacizilor conținute în ea. Astfel, proprietățile individuale și funcția proteinei datorită structurii și ordinea aminoacizilor în intercalarea lanț polipeptidic.
lanțuri polipeptidice diferite de corp proteine pot cuprinde mai mulți aminoacizi de până la sute și mii de resturi de aminoacizi. Greutatea moleculară a lor (mol. greutate), de asemenea, variază foarte mult. Astfel, hormonul vasopresina constând din 9 aminoacizi, spun ei. masa de 1070 kDa; insulina - 51 aminoacizi (2 lanțuri), mol. masa de 5733 kDa; Lizozimul - din 129 aminoacizi (un lanț), mol. greutate 13930 kD; hemoglobina - de la 574 aminoacizi (4 lanțuri), mol. greutate 64.500 kD; colagen (tropocollagen) - de aproximativ 1000 de aminoacizi (3 lanțuri), mol. greutate
Proprietăți și funcția proteinei depinde de structura și ordinea aminoacizilor în lanțul alternativ, modificarea compoziției de aminoacizi le poate schimba mult. Astfel, doi posterior hormon hipofizar - oxitocina si vasopresina - sunt nanopeptidami și 2 aminoacizi diferă de la 9 (la poziția 3 și 8):
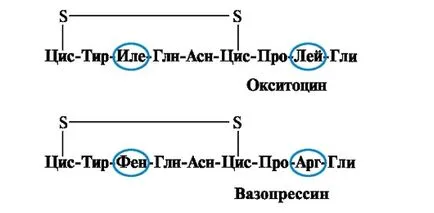
Efectul biologic principal este stimularea oxitocină a contracției mușchiului neted uterin în timpul nașterii, iar apa vasopresina provoaca reabsorbtia in tubii renali (hormon antidiuretic) și posedă proprietăți vasoconstrictoare. Astfel, în ciuda marilor similitudinile structurale, activitatea fiziologică a acestor peptide și țesutul țintă pentru care funcționează, sunt diferite, adică, înlocuirea numai 2 din 9 peptide aminoacizi determină o modificare semnificativă a funcției.
Uneori, foarte puține schimbări în structura unei proteine mare determină suprimarea activității sale. Astfel, alcool dehidrogenaza enzima care scindează etanol în ficatul uman, este format din 500 aminoacizi (4 lanțuri). activitatea sa în rândul locuitorilor din Asia (Japonia, China, și altele.) sunt mult mai mici decât cele ale cetățenilor europeni. Acest lucru se datorează faptului că un lanț polipeptidic al enzimei este înlocuită acid glutamic la lizină de la poziția 487.
Interacțiunile dintre radicalii amino joacă important în stabilizarea structurii spațiale a proteinelor pot fi identificate patru tipuri de legături chimice: hidrofobe, hidrogen, ionic, bisulfura.
legături hidrofobi apar între radicalii nepolari hidrofobe (Fig. 2). Acestea joacă un rol principal în formarea structurii terțiare a moleculei de proteină.
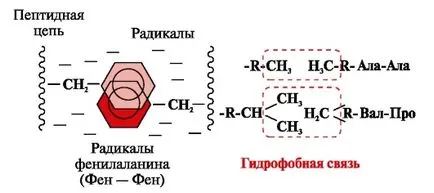
Fig. 2. interacțiunile dintre radicalii hidrofobi
legături de hidrogen - sunt formate între grupările polare (hidrofile) de către radicalii neîncărcate având un atom de hidrogen mobil, și grupări cu un atom electronegativ (-O sau -N) (figura 3).
legături ionice sunt formate între polari radicali (hidrofile) ionice având grupări încărcate opus (Fig. 4).
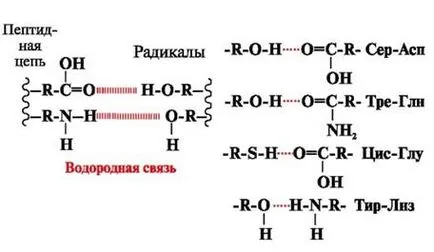
Fig. 3. legături de hidrogen între radicali de aminoacizi
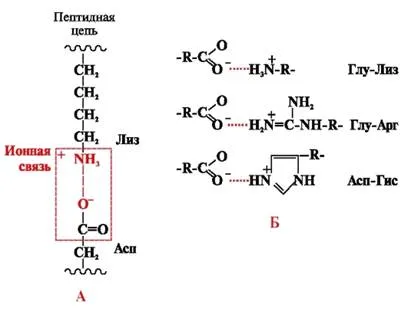
Fig. 4. Legătura ionică dintre lizina radicalii și acidul aspartic (A) și exemple de interacțiuni ionice (B)
Legăturii disulfidice - covalenta, formată de două sulfhidril (tiol) grupări de radicali cisteină, în diferite locații ale lanțului polipeptidic (Figura 5.). Ea apare în proteine, cum ar fi insulina, receptorul de insulină, imunoglobuline, și altele.
legături disulfidice stabilizează structura tridimensională sau un singur lanț polipeptidic asociat cu fiecare alte 2 lanțuri (de exemplu, A și B lanțuri ale hormonului insulină) (Fig. 6).
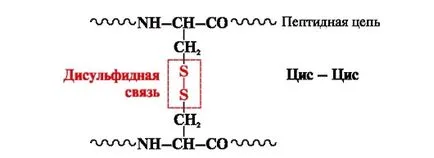
Fig. 5. Formarea legăturii disulfurice.
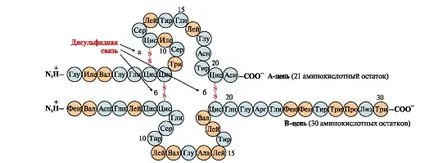
Fig. 6. Legătura bisulfura în molecula de insulină. legături disulfurice: una între resturile de cisteină ale lanțului A (a) între lanțurile A și B (b). Cifrele - poziția aminoacizilor din lanțurile polipeptidice.