Legătura chimică
Doctrina legăturii chimice este baza tuturor chimiei teoretice.
Sub o astfel de legături chimice să înțeleagă interacțiunea dintre atomii care le leagă la molecule, ioni, radicali. cristale.
Există patru tipuri de legături chimice: ionice, covalente, metalic și hidrogen.
Liantul chimică ionic - o legătură formată prin atracția electrostatică de cationi de anioni.
După cum știți, acest lucru este configurația electronică cea mai stabilă a atomilor în care, la nivel de electroni exterior, cum ar fi atomi de gaz nobil, electronii vor fi 8 (sau pentru primul nivel de energie - 2). Când interacțiunile chimice atomii tind să cumpere doar astfel de configurație electronică stabilă și pentru a realiza acest lucru în mod frecvent, sau prin adăugarea de electroni de valență ai altor atomi (proces de recuperare) sau ca urmare a impactului lor electronilor de valență (un proces de oxidare). Atomi electroni adere „străine“ sunt transformați în ioni negativi sau anioni. Atomii care doneaza electronii, transformați în ioni pozitivi sau cationi. Este clar că între anioni și cationi de o forță de atracție electrostatică, care le va avea unul lângă altul, făcând astfel o legătură ionică.
Deoarece cationii formează un atom în general din metal, și anioni - atomi metaloid, este logic să se concluzioneze că acest tip de conexiune este caracteristic pentru compușii din metale tipice (elemente de grupa principala I și grupele II, altele decât magneziul și beriliu Be), cu nemetale tipice (elemente din grupa principală grupa VII). Un exemplu clasic este formarea de halogenuri de metale alcaline (fluoruri, cloruri, etc.). De exemplu, să considerăm un sistem pentru formarea de legături ionice în clorură de sodiu:
Două forțe asociate cu ioni de atracție încărcate opus, nu își pierd capacitatea de a interacționa cu ioni încărcați opus, rezultând formarea unui compus cu un grilaj cristalin ionic. Compușii ionici sunt un material dur, rezistent, refractar, cu un punct de topire ridicat.
Soluții sau topituri majoritatea compușilor ionici - electroliti. Acest tip de conexiune este caracteristic pentru hidroxizi metalici tipice și săruri ale multor acizi oxigenați. Cu toate acestea, formarea unei legături ionice are loc transferul ideale (complet) de electroni. Liantul ionic este un caz extrem al unei legături covalente polare.
Ionice ionii de compuși sunt prezentate ca și în cazul în care sub forma unor sarcini electrice cu simetrie sferică a câmpului electric este la fel în scădere cu creșterea distanței de la centrul de încărcare (ion) în orice direcție. Prin urmare, interacțiunea ionilor este independentă de direcție, adică, o legătură ionică, spre deosebire de covalente, este non-direcțională.
Ionic legătură există și în săruri de amoniu, în care nu există atomi de metal (rolul lor de cationi de amoniu).
legătură chimică covalentă
legătură chimică covalentă - o legătură între atomii se produce schaya prin formarea unei perechi de electroni comune.
Ea se bazează pe ideea descrie, de asemenea, achiziționarea de atomi de elemente chimice configurare electronice energetic favorabil și stabil de opt electroni (atomul de hidrogen al celor două). O astfel de configurație a atomilor care nu este obținut prin impact de electroni sau care unește, ca și în cazul legăturii ionice, prin formarea unei perechi de electroni comune. Mecanismul de formare a unei astfel de conexiuni pot fi schimbate sau donor-acceptor.
Mecanismul de schimb care acționează atunci când atomii formează perechi de electroni partajate prin combinarea electroni nepereche. De exemplu:
Comunicarea are loc prin formarea de perechi de electroni totale s-electron ale atomilor de hidrogen (care se suprapun s-orbitali):
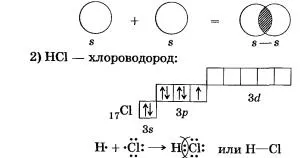
Comunicarea are loc prin formarea unei perechi de electroni totală de electroni p-S și (suprapunere s-p orbitali):
Formarea mecanismului de legătură covalentă Donor-acceptor, luați în considerare exemplul clasic al formării de amoniu NH4 + ion:
Donator are acceptor de electroni pereche - orbital liber pe care această pereche poate lua. Legătura de ioni de amoniu, cu toți cei patru atomi de hidrogen ai covalente trei formate prin crearea unei perechi de electroni comun de atomi de azot și atomi de hidrogen de pe mecanismul de schimb, un format pe un mecanism donor-acceptor. Toate cele patru legături N-H în echivalentul cation de amoniu.
De asemenea, legătura donor-acceptor în metilamoniu ion [SN3NH3] +.
Legăturile covalente sunt clasificate nu numai prin mecanismul de formare a perechilor de electroni care leagă atomii de partaj, ci și prin metoda de suprapunere de electroni orbită leu, în funcție de numărul de perechi de electroni partajat, iar deplasarea unuia dintre atomii asociați.
Conform metodei de suprapunere orbitali electroni distinge legături covalente sigma și pi.
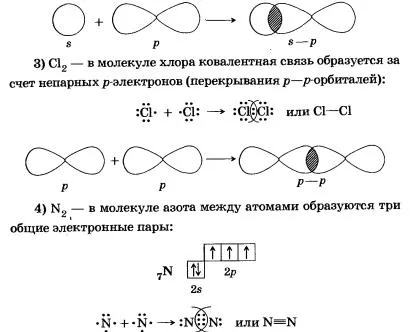
Molecula de azot este o pereche de electroni comună este formată dintr-o legătură sigma (densitatea de electroni este într-o regiune situată pe linia care unește nucleele atomilor; bond durabile).
Alte două perechi de electroni comune sunt formate de I-obligațiuni, adică, laterale suprapuse p orbitali din cele două regiuni; pi-legătură mai slabă decât legătură sigma.
Atomii de azot există între molecula sigma-legătura și două legături pi care sunt în plane reciproc perpendiculare (din p interacționare 3 electron nepereche fiecărui atom).
Prin urmare, o conexiune poate fi formată datorită suprapunerii de orbitali de electroni:
și, de asemenea, datorită suprapunerii de „curate“ și hibride orbitali:
sp 2 -SR 2 (C2H4), și altele asemenea. d.
Prin numărul de perechi partajate de electroni, atomi de legătură, adică, prin multiplicitatea, legături covalente distinși:
monoxid de carbon (IV)
3) ferz:
C2H2
HC = CH Acetilena
Prin gradul de polarizare perechi comune de electroni conectate la una legătura covalentă a atomilor poate fi nepolar și polar. Când perechile de electroni legături covalente nepolare partajate nu sunt deplasate la oricare dintre atomii, deoarece acestea au aceiași atomi electronegativitate (EO) - proprietatea de a întârzia valență în prezent electroni ai altor atomi.
Legătură covalentă formate între atomii de carbon ai aceluiași electronegativitatea, numit nepolare.
Prin legături covalente se formează substanța simplă molecula metaloid nepolar.
Valorile electronegativitatea relative de fosfor și hidrogen sunt practic identice: EA (H) = 2,1; EE (F) = 2,1, astfel încât în moleculă obligațiuni fosfină PH3 între atomul de fosfor și o covalentă nepolară atom de hidrogen.
Covalentă legătură între atomii de elemente care sunt electronegativitate diferite, numite polar
Azot - element de mai electronegative decât hidrogen, astfel încât perechile de electroni de ansamblu sunt deplasate la atomul său.
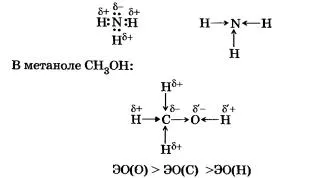
Este necesar să se facă distincția polaritatea moleculei și polaritatea conexiunii. Polaritatea conexiunii depinde de valorile electronegativitate atomilor legați, și polaritatea moleculei depinde de polaritatea și geometria moleculei. De exemplu, comunicarea într-o moleculă de dioxid de carbon C02 va fi molecula polară și polară nu va deoarece are o structură liniară.
molecula de apă H20 polar, deoarece acesta este format din două legături covalente polare H> 0 și are o formă unghiulară. Unghiul de HOH legătură 104,5 °, astfel încât atomul de oxigen cu sarcină negativă parțială 6 și două perechi de electroni nepuse formate de polul negativ al moleculei, în timp ce atomii de hidrogen ai taxa 6+ - pozitiv. Molecula de apă - dipol.
Substanțe cu o legătură covalentă caracterizată printr-o rețea cristalină de două tipuri:
Atomic - foarte durabil (diamant, grafit, cuarț); molecular - în condiții normale sunt gaze, fluide volatile și materiale solide, dar fuzibil sau sublimează (Cl2, H20, iod I2, «gheață uscată“ și altele C02.).
legătură covalentă intramoleculară este puternic, dar interacțiunea intermoleculară este foarte slabă, astfel încât rețeaua cristalină moleculară este instabilă.
Comunicarea în metale și aliaje care operează electroni relativ libere între ionii metalici în rețeaua cristalină a metalului, metalul este numit.
O astfel de comunicare non-direcțional, nesaturat, caracterizat printr-un număr mic de electroni de valență și un mare număr de orbitali liberi, ceea ce este tipic pentru atomii de metal. Schema legăturii metalice (M - metal):
_
M 0 - ne <-> M n +
Prezența conexiunii metalului cauzată de proprietățile fizice ale metalelor și aliajelor, duritate, conductivitate electrică și o conductivitate termică, ductilitate, plasticitate, luciu metalic. Substanțe cu legături metalice au un grilaj metalic. In nodurile sunt ionii metalici sau atomi, între care liber (în interiorul cristalului) electronii se deplasează ( „gaz de electroni“).
Liantul chimică între atomii polarizată pozitiv de hidrogen ai unei molecule (sau o porțiune a acesteia) și atomii polarizat negativ puternic elemente electronegative având o singură pereche de electroni a unei alte molecule (sau o porțiune a acesteia) este denumită hidrogen.
Mecanismul de formare a legăturii de hidrogen are parțial parțial natură electrostatică donor-acceptor. Cu această conexiune, chiar și substanțele cu greutate moleculară mică pot fi lichide în condiții normale (alcool, apa) sau ușor gazele lichefiabile (amoniac, ftorovodo-genus).
Biopolimerilor - proteine (structura secundară) are o legătură de hidrogen intramoleculare între oxigen carbonil și hidrogenul amino.
molecula polinucleotidică - ADN (acid dezoxiribonucleic) este un dublu helix în care cele două lanțuri de nucleotide conectate între ele prin legături de hidrogen. Astfel, principiul complementarității, adică acele legături sunt formate între anumite perechi alcătuite din baze purinice și pirimidinice: nucleotide adenină împotriva (A) este timină (T) și împotriva guanina (G) - citozină (C).
Substanțe cu legături de hidrogen molecular au barilor de cristal.
Caracterul uniform al legăturii chimice
Divizarea privind tipurile de legături chimice este condiționată, deoarece acestea sunt caracterizate printr-o anumită unitate.
legătură ionică poate fi considerată ca un caz limitativ al unei legături covalente polare.
Liantul metalic combină interacțiunea covalente cu atomii și electronii socializat prin atracția electrostatică dintre electroni și ioni metalici.
Substanțele sunt adesea lipsesc legătura chimică limitarea cazurilor (sau legături chimice „pure“).
De exemplu, fluorură de litiu 1lK se referă la compuși ionici. De fapt, se face apel la 80% și 20% ionic covalent. Corect, astfel încât, în mod evident, vorbim despre gradul de polaritate (ionicity) o legătură chimică.
Dintre halogenuri HF - HCl - HBr - HI - grad Naț scade polarității datorate, pentru reducerea diferenței de valori electronegativitate de atomi de halogen și hidrogen, și comunicarea acid astatinhidric devine aproape nepolari (EO (H) = 2,1; EA (Ar) = 2.2).
Diferite tipuri de obligațiuni pot fi conținute într-una și aceeași substanță, de exemplu:
1) în bazele - între atomii de oxigen și hidrogen în gidroksogrupp legătură covalentă polară și între metalul și gidroksogrupp - ion;
2) săruri acide ale oxigenați - atomi metaloid între fragmentul de acid și oxigen - covalentă polară, între un metal și un rest de acid - ion;
3) săruri de amoniu, metilamoniu etc. - între atomii de azot și hidrogen - covalentă polară, și între ioni-E și acid de amoniu sau metilamoniu reziduu - ion ..;
4) un peroxizi metalici (de exemplu, Na2 O2) - legătura dintre covalentă nepolară atom de oxigen și între metal și oxigen - ion, etc ...
Diferite tipuri de link-uri pot trece unul pe altul:
• când disocierea electrolitică a apei covalente-TION compuși polari legătură covalentă ionică devine;
• evaporarea metalelor este transformată în metal nepolară legătură covalentă și t. D.
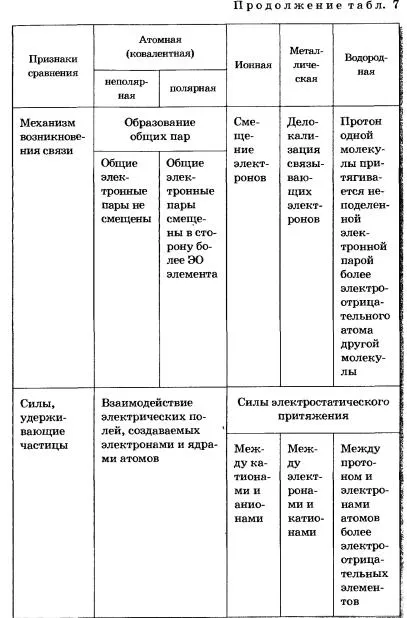
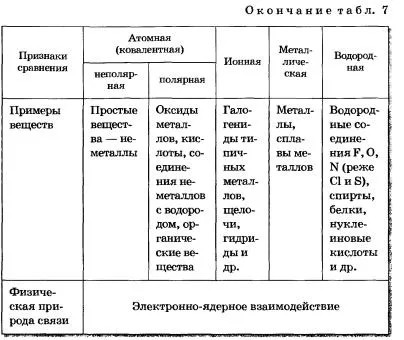
Motivul pentru unitatea de toate tipurile și tipurile de legături chimice este de aceeași natură fizică - interacțiunea electron-nucleare. Formarea legăturii chimice, în orice caz, este un rezultat al atomilor de interacțiune electron nuclear, însoțită de eliberarea de energie (tabelul. 7).
TABELUL 7 tipuri de produse chimice de comunicare

1. Adesea, există o zicală: „gaze nobile Moleculele monoatomice“ În măsura în care aceasta corespunde adevărului?
2. De ce, spre deosebire de cele mai multe elemente, non-metalice, cele mai reprezentanți de seamă ai acestora - halogeni - nici o formă de modificări alotropice?
3. Se permite caracterizarea mai completă a legăturii chimice în molecula de azot, folosind următoarele semne: EO atomi legați, mecanismul de formare, metoda de suprapunere orbitali de electroni multiplicitate de comunicare.
4. Identificați tipul legăturii chimice, și a vedea formarea sa circuit materiale având formula: Ca CaF2, F2, OF2.
5. Scrieți formulele structurale ale substanțelor: CO, CaC2, CS2, FeS2. Se determină starea de oxidare a elementelor și valența acestora (în cazuri posibile) pentru substanțele respective.
6. Dovedește că toate tipurile de legături chimice au o origine comună.
7. De ce sunt moleculele de N2, CO și C2H2 numit izoelectronice?
Dacă aveți corecturi sau sugestii la această lecție, vă rugăm să ne contactați.
Dacă doriți să vedeți alte ajustări și sugestii pentru lecții, uita-te aici - Forumul Educațional.