Investigarea denaturarea proteinei sub efectul detergenților neionici - abstract, pagina 1
1. Proteinele și structura acestora. 3
2. Denaturarea proteinelor 8
3. Detergenți 10
4. Denaturarea de detergent ionic 12
1. Proteinele și structura acestora.
Proteine - molecule de polimer în care monomerii sunt aminoacizi. lanțuri peptidice contin zeci, sute sau mii de aminoacizi legate prin legături peptidice puternice. Datorită interacțiunilor intramoleculare de proteine formează o anumită structură spațială, numită „conformație de proteine“. Secvența lineară de aminoacizi din proteina conține informații despre construcția structurii spațiale tridimensionale. 4 niveluri de organizare structurală a proteinelor, numite primare, secundare, terțiare și cuaternare structuri (fig. 1.1). Există reguli generale care există o formațiune de structuri tridimensionale de proteine.
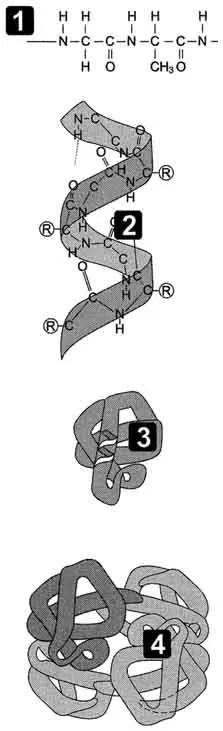
Fig. 1.1 - Etapele conformației proteinelor. 1 - Structura primară; 2 - Structura secundară; 3 - structura terțiară; 4 - structura cuaternară.
Resturile de aminoacizi din catena peptidică proteinelor nu alterna aleator, și sunt aranjate într-o anumită ordine. Secvența lineară a resturilor de aminoacizi din lanțurile polipeptidice sunt numite „structura primară a proteinei.“
Fiecare dintre cele 50 000 de corp proteine individuale umane este unic pentru structura proteinei primare. Toate moleculele individuale de proteine au aceeași alternanța de resturi de aminoacizi într-o proteină care distinge în primul rând individul de orice altă proteină.
Liniare lanțuri polipeptidice individuale ale proteinelor datorate interacțiunii grupelor funcționale de aminoacizi dobândi o anumită structură spațială tridimensională, numită „conformație“. Toate moleculele de proteine individuale (adică având aceeași structură primară) pentru a forma o soluție conformație uniformă. Prin urmare, toate informațiile necesare pentru formarea modelelor spațiale stocate în structura primară a proteinelor.
Proteinele se disting două tipuri de bază lanțuri polipeptidice conformație: structura secundară și terțiară.
Structura secundară a proteinelor - structura spațială formate ca rezultat al interacțiunilor dintre grupările funcționale ale membrilor scheletului peptidic. Astfel, lanțurile peptidice pot dobândi structuri regulate de două tipuri: α-helix și β-structură.
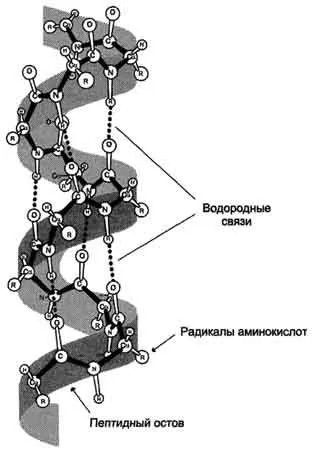
În formarea de legături de hidrogen sunt implicate în aproape toate de oxigen și atomi de hidrogen grupe de peptide. Ca rezultat, α-helix „tras împreună“ multiple legături de hidrogen. În ciuda faptului că datele de comunicare face parte din categoria de slabe, numărul lor oferă cea mai mare stabilitate posibilă a α-helix. Deoarece toate grupările hidrofile ale scheletului peptidic obicei implicate în formarea de legături de hidrogen, hidrofilicitatea (adică, capacitatea de a forma legături de hidrogen cu apa) a-helix scade și crește hidrofobicitatea acestora.
Fig. 1.2- -Helix. Figura prezintă structura spațială -spiralized porțiune din lanțurile polipeptidice și formarea de legături de hidrogen implicate în formarea -helix.
-Structura este formată prin formarea unei multitudini de legături de hidrogen între atomii din grupurile de peptide ale regiunilor liniare ale unui singur lanț polipeptidic, făcând coturi, sau între diferite lanțuri de polipeptide, β-structură formează o figură similară cu o foaie, pliată „acordeon“, - p-plisat strat (Figura 1.3. ).
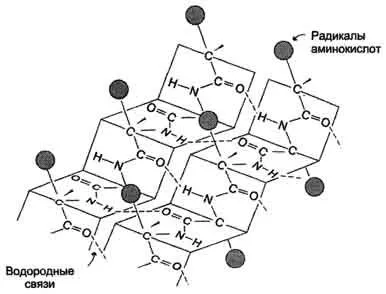
Fig. 1.3 - Structura secundară a proteinelor în formă de strat β cutat.
Atunci când legăturile de hidrogen formate între atomii din scheletul peptidic din lanțuri polipeptidice diferite, denumite legături ca intercatenare. legături de hidrogen care au loc între secțiunile liniare într-un singur lanț polipeptidic, numită intralant. În structurile de legătură -hidrogen aranjate perpendicular lanț polipeptidic.
Structurii terțiare a proteinelor - structura spațială tridimensională formată datorită interacțiunilor dintre radicalii de aminoacizi care pot fi amplasate la o distanță considerabilă unul față de celălalt în lanțul polipeptidic.
Când de stabilire a lanțului polipeptidic al proteinei tinde să devină formă energetic favorabil, caracterizat printr-un minim de energie liberă. De aceea, radicalii amino hidrofobi tind să se unească în structura globulară a proteinelor solubile în apă. Între ele sunt așa-numitele interacțiuni hidrofobe, și van der Waals între atomii strâns învecinate. Ca rezultat, miezul hidrofob este format în interiorul Globula proteine. Grupările hidrofile ale scheletului peptidic în formarea de structuri secundare formează o pluralitate de legături de hidrogen, evitându-se astfel legarea lor cu apă și distrugerea structurii dense interioare a proteinei.
radicali amino hidrofilice tind să formeze legături de hidrogen cu apă și, prin urmare, sunt localizate în principal pe suprafața moleculei de proteină.
Toate grupurile hidrofile amino radicali prinse în interiorul miezului hidrofob, interacționează între ele prin legături ionice și hidrogen.
lipirea Ionic poate avea loc între grupele încărcate negativ (anionic) carboxil ale radicalilor de acid aspartic și glutamic și încărcat pozitiv (cationic). legături de hidrogen apar între grupări neîncărcate hidrofili (cum ar fi -OH, -CONH2. SH-grupuri), precum și orice alte grupări hidrofile. Proteinele care funcționează într-un (lipide) mediu nepolare, astfel de proteine cu membrana sunt dispozitivul converse: radicali amino hidrofilice sunt localizate în interiorul proteinei, în timp ce aminoacizii hidrofobi sunt localizate pe suprafața moleculei și pusă în contact cu un mediu nepolar. In fiecare caz, radicalii de aminoacizi ocupă poziția cea mai avantajoasă din bioenergie.
Mai multe structuri terțiare a proteinelor este stabilizată legături disulfurice formate datorită interacțiunii dintre cele două SH grupuri de resturi de cisteină. Aceste două reziduuri de cisteină pot fi departe unul de altul în structura primară liniară a proteinei, dar formarea structurii terțiare, ele converg și formează un puternic radicali de legare covalente.
Cele mai multe proteine intracelulare îi lipsesc legături disulfidice. Cu toate acestea, astfel de comunicări sunt frecvente in proteine secretate de către celula în spațiul extracelular. Se crede că aceste legături covalente stabiliza formarea con de proteine în afara celulei și pentru a preveni denaturarea acestora. Aceste proteine includ insulina si imunoglobuline.
Toate proteinele cu aceeași structură primară, care sunt, în aceleași condiții, același câștig caracteristica conformației proteinelor individuale determină funcția specifică. conformație Functional activă a proteinei numita „structură nativă“.
În cazul în care lanțul polipeptidic al proteinei conține mai mult de 200 de aminoacizi, de obicei, structura sa spațială formată în forma a două sau mai multe domenii. Domeniu - porțiune a lanțului polipeptidic, care, la formarea structurii spațiale a dobândite independent de alte porțiuni ale aceluiași lanț formarea con a unei proteine globulare. Astfel, lanțul G de imunoglobulină ușoară constă din două domenii. În unele cazuri, numele de domeniu părțile structurale ale lanțului polipeptidic.
Domeniile pot fi identificate, în general, prin acționarea asupra proteinei prin enzime proteolitice, legături simple peptidice sfâșiere în porțiunea de lanț polipeptidic situată între domenii. După aceea, unele domenii pot păstra proprietățile lor biologice.
Multe proteine conțin în componența sa de un singur lanț polipeptidic. Astfel de proteine sunt numite monomeri. La un monomer și includ proteine care constau din mai multe circuite, dar sunt legate covalent, cum ar fi legături disulfurice (deci insulină trebuie considerată ca o proteină monomerică).
În același timp, sunt proteine care constau din două sau mai multe lanțuri polipeptidice. După formarea structurii tridimensionale a fiecărui lanț de polipeptide sunt combinate folosind aceleași interacțiuni slabe care au participat la formarea structurii terțiare: hidrofobe, ionice hidrogen.
Numărul și poziția relativă în spațiu a lanțurilor polipeptidice numite „structura cuaternară a proteinelor.“ Individuale lanțurile polipeptidice într-o proteină sunt numite protomers sau subunități. Proteina care conține în compoziția mai multe protomers sale, numit oligomeric. Compoziția poate include proteine oligomere de la două până la câteva zeci de protomers, deși cel mai des întâlnit de proteine care conțin două până la patru lanțuri de polipeptide, proteine (tetramerice dimere).
Proteinele joacă un rol central în punerea în aplicare și reglementarea aproape toate procesele vitale care au loc în organismele vii la nivel molecular, astfel încât problema relației dintre structura și funcția de macromolecule de proteine este una dintre problemele centrale în știința modernă. Pentru ca proteinele să-și îndeplini eficient funcția lor, necesită o anumită stabilitate a macromoleculei de proteine. Macromolecula proteină capabilă să sufere modificări structurale sub influența diferiților agenți.