gradul de disociere
„Comportamentul soluțiilor apoase de electroliți în reacțiile chimice depinde în mare măsură de modul în care pe deplin disociază în ioni. Pentru a cuantifica parametrii de disociere sunt importante ca gradul și constanta de disociere.
Gradul de disociere și - raportul dintre numărul de molecule de dezintegrată în ioni, la numărul inițial de molecule de solut:
Gradul de disociere este uneori exprimată în procente:
Gradul de disociere a electrolitului depinde de concentrația soluției: concentrația scade odată cu scăderea interacțiunii ionilor în soluție, ceea ce conduce la formarea de molecule, prin urmare, crește gradul de disociere. După gradul de disociere a electroliților pot fi împărțite în puternic, mediu și slab. electroliți puternici au o> 30%; slab - și <3%; средние - а в пределах от 3 до 30%.
Prin electroliți puternici în soluții apoase sunt aproape toate săruri, majoritatea acizilor anorganici (HNO3. HCI, H2 SO4. HClO4 și colab.) Și hidroxizi ai metalelor alcaline și alcalino-pământoase. Electroliții medii sunt H2 SO3. H3 PO4 și colab., Compuși, cum ar fi H2S, Cu (OH) 2 și altele. Sunt electroliții slabi.
Divizia de electroliți slabi, medii și puternice sunt convenționale, deoarece gradul de disociere în funcție de natura electrolitului și solventul, concentrația și temperatura soluției. Soluțiile apoase ale diferitelor săruri, acizi și baze de aceeași concentrație disociază în ioni în grade diferite. Gradul de disociere semnificativ afectată de prezența ionilor similari în soluție. Astfel, în cazul în care există o soluție CuCI2. sistemul de echilibru
„Procesul este opusul electrolitic molizatsiya disociere - ioni reunirii semne opuse în moleculă neutră. Dacă există o stare dinamică, mobilă de disociere între procese și molizatsii, și apoi găsit din ecuația:
Dacă avem. și anume în soluții slabe de aproape toate moleculele sunt disociate. Odată cu creșterea concentrației unei soluții scade. În soluții foarte concentrate
Sunt foarte neobișnuit și electroliți. De exemplu, electrolitul este o sticlă, care este un lichid foarte racim având o vâscozitate enormă. Când este încălzit, sticla se înmoaie și vâscozitatea este puternic redusă. prezent sodiu în sticlă ionii Na + devin mobilitate apreciabilă, și devine posibil să curgă curent electric, cu toate că la temperaturi obișnuite, sticla este un bun izolator.
O demonstrație clară a acestui fapt este experiența, circuitul este prezentat în Figura 2.
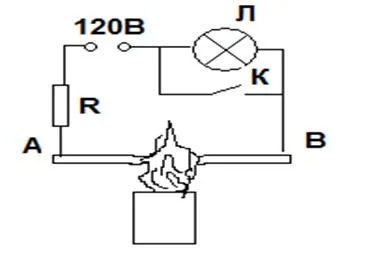
Demonstrarea conductibilitate sticlei atunci când este încălzit