gaz de sinteză
Prima metodă de obținere a gazului de sinteză a gazeificarea cărbunelui, care a fost efectuat în 30-e din secolul XIX, în Anglia, în scopul de a obține gazele combustibile de hidrogen, metan, monoxid de carbon. Acest proces este utilizat pe scară largă în multe țări, până la mijlocul anilor '50 ai secolului XX, și mai târziu a fost înlocuită prin metode bazate pe utilizarea de gaze naturale și petrol. Cu toate acestea, ca urmare a reducerii valorii resurselor de petrol ale procesului de gazificare a început să crească din nou. În prezent, există trei metode industriale majore pentru producerea gazului de sinteză. 1. gazeificarea cărbunelui. Procedeul se bazează pe reacția de cărbune cu vapori de apă:
Această reacție este endotermă, echilibru trecerea la dreapta la temperaturi de 900-1000 ° C. Procesele tehnologice care folosesc suflare cu abur de oxigen, în care respectiva reacție, împreună cu o reacție exotermă a arderii cărbunelui, care asigură echilibrul termic dorit:
2. Conversia metan. Reacția metan cu interacțiunea vapori de apă este condusă în prezența unui catalizator de nichel (Ni-Al2 O3) la temperaturi ridicate (800-900 ° C) și o presiune de:
Orice materie primă de hidrocarburi poate fi utilizat ca materie primă în loc de metan. 3. oxidarea parțială a hidrocarburilor. Procedeul implică oxidarea termică parțială a hidrocarburilor, la temperaturi de peste 1300 ° C:
Metoda este aplicabilă oricărei materii prime de hidrocarburi, dar este cel mai adesea în industria folosesc o fracțiune petrolieră cu punct de fierbere ridicat - ulei. raportul CO. H2 depinde în mod esențial de procedeul de obținere a gazului de sinteză. În gazeificarea cărbunelui și oxidare parțială, raportul este aproape de 1. 1, în timp ce raportul dintre conversia metanului CO. H2 este 1. 3. Proiectele sunt dezvoltate de gazificare în subteran, adică gazeificarea cărbunelui direct în formațiune. Interesant, această idee a fost exprimată de DI Mendeleev în urmă cu mai mult de 100 de ani. Gazul de sinteză Termenul va primi nu numai gazeificarea cărbunelui, dar, de asemenea, alte surse de carbon până la deșeurile municipale și agricole.
monoxid de carbon, carbonili de metal și de electroni regula 18
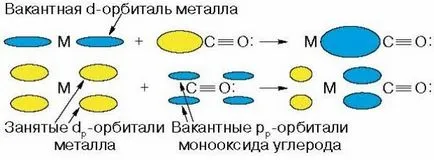
Numeroase sinteze bazate pe monoxid de carbon și hidrogen sunt enorme atât practice și interes teoretic, deoarece acestea permit a două substanțe simple de a obține compuși organici valoroși. Aici, un rol decisiv este jucat de cataliză cu metale de tranziție, care sunt capabile să activeze molecule inerte de CO și H2. Activarea moleculelor - este traducerea lor într-o stare mai reactivă. De notat special, este faptul că, în conversia gazului de sinteză pe scară largă a dezvoltat un nou tip de cataliză - (. A se vedea articolul O. Temkin [4]) cataliza complecși metalici de tranziție sau cataliză complex metalic. Deci, dacă molecula inertă de CO? Reprezentări ale inerției de monoxid de carbon sunt condiționate. Mai multe godu Mond în 1890 a primit de nichel metalic și compus carbonilic întâi metalic monoxid de carbon, un lichid volatil, cu un punct de fierbere de 43 ° C - Ni (CO) 4. Interesat de istoria acestei descoperiri, care pot fi atribuite la voia întâmplării. Mond, explorarea cauzelor de coroziune rapidă a reactoarelor de nichel în producția de sodă NaCl, amoniac și CO2. a constatat că cauza coroziunii este prezența impurităților în CO2 de monoxid de carbon, care reacționează pentru a forma nichel tetracarbonil Ni (CO) 4. Aceasta descoperire a permis Mond dezvolte în continuare metode de purificare nichel prin obținerea nichel carbonil volatile și descompunerea ulterioară termică din nou la nichel și SB. Dupa 25 de ani și a fost deschis accidental fier carbonil - Fe (CO) 5. Când compania BASF a deschis mult uitate bombă de oțel cu CO la partea inferioară a descoperit lichid galben - pentacarbonil de fier, care este format treptat din reacția metalului de fier cu CO la o presiune ridicată. Deoarece carbonilii metalici sunt compuși foarte toxici relevante pentru ei inițial chimiștii a fost destul de rece, dar ulterior au fost descoperite proprietăți surprinzătoare, inclusiv catalizator, se determină utilizarea lor extensivă, în special în chimia de monoxid de carbon. Rețineți că multe dintre metalele sub formă fin divizată poate reacționa direct cu monoxid de carbon, dar în acest fel primesc numai carbonili de fier și nichel. Alte carbonili metalice obținute în reducerea compușilor acestora în prezența CO la presiuni ridicate. Compunerea complecși carbonil ai metalelor de tranziție pot fi prezise pe baza regulii 18, electronii, prin care un complex este stabil dacă cantitatea de metal de electroni de valență și electronii furnizate de ligand, în acest caz, CO, va fi egală cu 18, deoarece, în acest caz, configurația electronică corespunde unei configurații stabile atomi nobile gaz (kripton). Molecula de monoxid de carbon are perechi de electroni neîmpărtășite, în care perechea de electroni pe carbon poate fi prevăzut pentru formarea unei legături cu un metal de tip donor-acceptor. Ca un exemplu, ia în considerare structura fier și nichel carbonil Fe (CO) 5 și Ni (CO) 4. atomi de fier și nichel au 8 și 10 electroni de valență și pentru a umple învelișul de electroni al atomului la configurația atomului de gaz nobil kripton îi lipsesc 10 și 8 electroni și astfel formarea de atom de fier carbonil trebuie să furnizeze perechile de electroni cinci molecule de CO și atom de nichel - patru . metalelor de tranziție cu un număr impar de electroni de valență formează o complecși binucleare carbonil. Astfel, pentru cobalt având nouă electroni de valență la configurație electronică stabilă îi lipsește nouă electroni. Complexe mononucleare datorită adoptării celor patru perechi de molecule de CO vor avea electroni nepereche, iar caracterul radical astfel particulele interacționează unele cu altele pentru a forma un metal-metal, iar rezultatul este un complex dimeric de Co2 (CO) 8. Reacția de monoxid de carbon sau coordonare cu metalul duce la o redistribuire a densității de electroni, nu numai CO, ci și pe metale, care influențează considerabil reactivitatea complexului de carbonil. Cel mai frecvent tip de așa-numita liniara de coordonate CO:
Când acest lucru se întâmplă nu numai că s-interacțiune datorită perechii de electroni libere de carbon, dar, de asemenea, p-reacția datorită transferului de electroni cu d-orbital al metalului pe disponibile orbitali vacante de carbon energiei: