faza termodinamică
Faza de termodinamică - o parte omogenă a unui sistem eterogen. delimitate de interfață [1] [2]. Mai puțin stricte, dar mai clar faze numite „o parte omogenă a sistemului, separate de restul suprafețelor vizibile ale secțiunii“ [3]. Astfel colecție omogenă de părți individuale ale sistemului având proprietăți similare, este considerată o singură fază (de exemplu, o multitudine de cristale de o singură substanță sau o multitudine de picături de lichid. Suspendat în componentele gazului și ceață) [4]. Fiecare fază este caracterizată printr-o ecuație de stare a sistemului [3].
Trecând prin interfața cel puțin o proprietate termodinamica a modificărilor substanței discontinuă [1] [5]. De multe ori (dar nu întotdeauna), interfața este vizibilă.
Sistemul Omogen cuprinde doar o singură fază; sistem eterogen alcătuit din două sau mai multe faze [6]. Sistem „gheață - apă - aer umed“ - trei faze eterogene. In diferite faze ale unui sistem cu un singur component poate fi reprezentat prin diferite stări agregate sau diferite modificări polimorfe ale materiei solide (ortorombică și sulf monoclinic. Gray și staniu alb etc.). [1]. Numărul de faze într-un sistem eterogen este supus regulii fazei Gibbs.
Faza de sistem multi-component poate fi diferită de compoziție și structură. În orice caz, prezența tranziției de fază înseamnă o posibilitate, în principiu, o substanță de la o etapă la alta. Sistemul polifazic este în echilibru termodinamic, dacă toate fazele sale sunt mecanic. echilibru termic și fază unul cu celălalt.
Gazul este întotdeauna compus dintr-un singur fluid de fază poate consta din mai multe faze lichide ale diferitelor compoziții, dar două lichide diferite ale compoziției nu pot coexista în echilibru (heliu lichid, - o excepție) (lichid lichefiere nemiscibile.). Substanța în stare solidă poate consta din mai multe faze, dintre care unele pot avea aceeași compoziție, dar diferite structuri (polimorfe, alotropie).
faze diferite au diferite variante de ambalare a moleculelor (pentru faze cristaline diferite Grile cristaline) și, prin urmare, valorile caracteristice ale factorului de compresibilitate, coeficientul de dilatare termică și alte caracteristici. Mai mult, diferite faze pot avea diferite electrice (feroelectricilor), proprietăți magnetice (feromagnetice) și optice (de exemplu, oxigen greu).
Faza de termodinamică în diagrama de fază
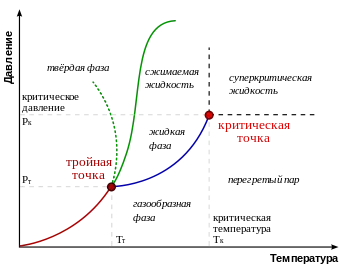
Tipuri tipice de diagrame de fază. Linia verde cu puncte indică un comportament anormal al apei
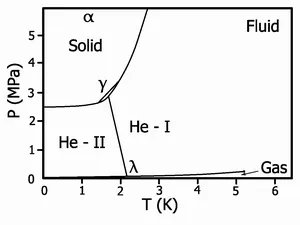
Diagrama de fază de heliu-4
În diagrama de fază a unei faze termodinamice materiale diferite ocupa anumite zone. Liniile de separare de fază termodinamic diferite, numite linii de tranziție de fază. În cazul în care substanța este într-un punct corespunzător într-o regiune, este în întregime în faza termodinamic. Dacă starea substanței corespunde punctului de pe una dintre liniile de tranziții de fază, substanța în echilibru termodinamic poate fi parțial într-una și parțial în cealaltă fază. Proporția celor două faze este determinată, sistem de obicei, plin de energie stocată.
Cu o schimbare lentă a presiunii sau a temperaturii substanței descrise la punctul se deplasează pe diagrama de fază. Dacă acest punct în mișcarea sa intersectează una dintre liniile care separă faza de termodinamică, are loc o tranziție de fază. în care proprietățile fizice schimbă brusc substanță.
Nu toate fazele sunt complet separate una de cealaltă printr-o linie de tranziție de fază. În unele cazuri, această linie se poate rupe, se încheie un punct critic. În acest caz, mai degrabă decât posibilă o tranziție treptată bruscă de la o fază la alta, ocolind liniile tranzițiilor de fază.
Punctul de pe diagrama de fază în cazul în care trei linii de tranziții de fază, numit punct triplu. De obicei, substanța punctul triplu se înțelege un caz special atunci când linia de topire converg, fierbere și sublimare, dar suficient de diagrame de fază bogate pot fi mai multe puncte triple. Cu privire la fond la punctul triplu în echilibru termodinamic poate fi parțial, în toate cele trei faze. Pe diagramele de fază multivariate (adică, dacă, în plus față de temperatură și presiune valorile prezente diferite intensive) pot fi puncte de cuaternari și alte.
Faza de termodinamică și starea de agregare a substanței
Set de faze termodinamice sunt stabilite de obicei mult mai bogată de stări agregate. adică, aceeași stare a materiei poate fi în diferite faze termodinamice. Acesta este motivul pentru care problema descrisă în termeni de stări de agregare mai degrabă grosolănie, și nu se poate distinge între anumite situații fizice diferite.
Un set bogat de fază termodinamic legat, de obicei, cu diferite exemple de realizare ale ordinului. sunt permise într-o anumită stare de agregare.
- Substanța gazoasă nu posedă nici o ordine. Prin urmare, orice substanță gazoasă are doar o singură fază termodinamic. (Tranziții de fază de disociere sau ionizarea moleculelor sunt, prin definiție, tranziții ale unei substanțe la alta).
- Are ordinul orientational a lichidului, dar de obicei nu are nici o ordine de translație. Ca rezultat, același fluid poate fi diferită de fază termodinamic, dar numărul lor depășește rareori unitate. De exemplu, existența unei noi faze lichide detectată în apă supraracita. Un alt exemplu - starea superfluid în heliu lichid.
- corp solid cristalin are atât de translație. și ordine orientational. Rezultatul este un număr mare de opțiuni posibile pentru orientarea moleculelor adiacente în raport una față de alta, care pot fi avantajoase din punct de vedere energetic sub anumite presiuni și temperaturi. Solidele rezultate au diagrama de fază, de obicei, destul de complexă. De exemplu, diagrama de fază a acestei substanțe aparent simplu ca gheața. Ea are cel puțin 12 faze termodinamice realizate la diferite temperaturi și presiuni.
Izolarea Faza - transformarea unui sistem omogen în două sau multifazic - utilizate pe scară largă în știință și inginerie.
Cristalizarea permite obținerea unor substanțe pure.
gaz - sub presiune ridicată fenomenul de separare în sistemul de gaz poate fi observată. Posibila existență a echilibrului eterogen al amestecului de gaze peste temperatura critică, sa afirmat mai Van der Waals. și apoi fenomenul a fost analizat prin Kamerlingh Onnes și Keesom. Dovezi experimentale ale acestui fenomen a fost mai întâi obținut prin sistemul exemplu de amoniac - azot în 1941 an. Inițial sa presupus că solubilitatea reciprocă limitată a fost observată numai în amestecuri de gaze care conțin componentul polar (amoniac. Sulfuri). Cu toate acestea, sa constatat ulterior amestecuri bundle heliu - dioxid de carbon. Heliu - etilenă și heliu - propan. Sistemul de heliu - existența etilenei a interfeței la solubilitatea reciprocă limitată a gazelor a fost confirmată prin observarea vizuală și fotografierea meniscului între cele două faze de gaz.
În cazul în care pachetul a amestecului de gaze, uneori, se observă un fenomen așa-numitele barotropic - schimbare plasează cele două faze coexistente cu o presiune tot mai mare. De exemplu, într-un sistem dual de NH3 (g.) - N2 (g) faza mai bogat în amoniac, are o densitate mai mare. Cu toate acestea, atunci când pachetul de amestec (90 ° C, 1800 atm (
1,84 kbar)) faza mai bogată în amoniac are deja o densitate mai mică și se ridică [7].