Exemple Mecanismul donor acceptor
Legătura chimică se numește o conexiune între doi sau mai mulți atomi (molecule) într-un compus organic sau anorganic. Acesta este format prin reducerea energiei totale furnizată în sistem.
în cazul în care toate elementele pot forma legături chimice
Toate elementele sistemului periodic au diferite capacitatea de a forma legături. Cel mai stabil și ca rezultat, sunt chimic atomi mai puțin active nobile gaze (inerte), deoarece acestea conțin în învelișul de electroni exterior a două sau opt electroni. Ele formează un număr mic de conexiuni. De exemplu, neon, heliu si argon nu formează legături chimice fie cu un element, în timp ce xenon, cripton, radon, și capabil să reacționeze cu moleculele de fluor și de apă.
Alte elemente niveluri atomi externe nu sunt finalizate și au unu până la șapte electroni, astfel încât să crească stabilitatea shell pentru a forma legături chimice.
Tipuri de legături chimice
Mai multe tipuri distincte de comunicare:
legătură covalentă
Acest tip de conexiune este formată între atomii din moleculă care rezultă în socializare sau suprapunere a perechii de valență de electroni. Prin urmare, există un schimb (a) și donor-acceptor (b) mecanisme pentru formarea unei legături covalente. Un caz separat este legătura dativ, care va fi discutat mai jos.
Legătură covalentă: mecanism de schimb
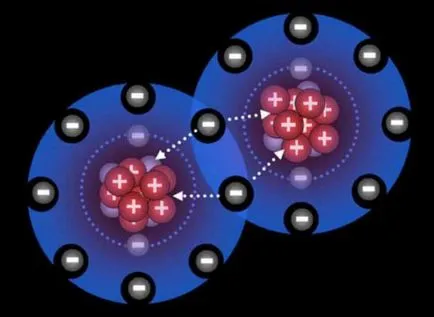
Atomii la nivel extern sunt electroni nepereche. În reacția suprapunerii mantalei exterioare. Antiparalel se rotește electronii singuri conținute în nivelurile externe imperecheze pentru a forma perechi de electroni partajate de doi atomi. Această pereche de electroni este, de fapt, o legătură covalentă, care este format la un mecanism de schimb, de exemplu, o moleculă de hidrogen.
Legătură covalentă: mecanismul donor-acceptor
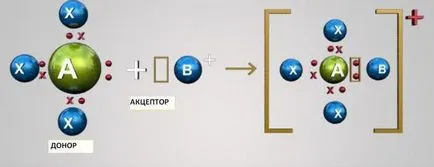
Acest mecanism constă în socializarea doi atomi de doi electroni sunt în exterior. În acest caz, unul dintre atomii acționează ca donatori (furnizate de doi electroni), iar celălalt - acceptor (care are un orbital vacant de electroni). Atomii de p-S și componentele pot fi fie acceptori sau donatori de electroni. D-elemente atomi pot fi donatori și acceptori.
Pentru a înțelege ce un mecanism donor-acceptor, ia în considerare două exemple simple - formarea de cationi hidroniu H3 O + și amoniu NH4 +.
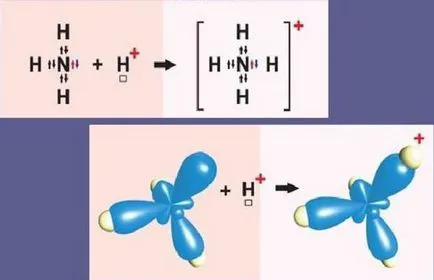
Un exemplu de mecanism donor-acceptor - cation de amoniu
Schematic, reacția de formare a particulelor de amoniu este după cum urmează:
Electronii din atomul de N sunt distribuite în următoarea ordine: 1s 2 2s 2 2p 3.
Electronic structura cation H: 1s 0.
Atomul de azot la nivelul exterior cuprinde două și p-S- trei electroni. Trei p-electron implicat în formarea a trei legături covalente de tip schimbător de legătură azot-hidrogen N-H. Aceasta are ca rezultat o molecula de amoniac NH3 cu o legătură covalentă. Deoarece atomul de azot N are la exterior o altă pereche de electroni s, molecula de NH3 se poate atașa, de asemenea, un cation hidrogen. Amoniacul este molecula donor și cationul de hidrogen H + - acceptor care acceptă electroni de azot donor proprii liberi s-orbital.
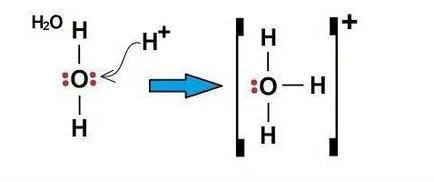
Un exemplu de mecanism donor-acceptor - H3O (hidroniu ion)
Electronii din atomul de oxigen distribuite în următoarea ordine: 1s 2 2s 2 2p 4.
un atom de oxigen la nivel exterior are două și patru s p electroni. Prin urmare, în formarea de legături H-O sunt implicate două libere p electroni și doi dintre atomii s-electroni doi H. Aceasta înseamnă că două legături disponibile în molecula H2O - covalente formate la mecanismul de schimb.
Structura electronică a cationului hidrogenului: 1s 0.
Deoarece atomul de oxigen la nivel extern erau încă doi electroni (de tip e), se poate forma o legătură covalentă un al treilea tip de mecanism donor-acceptor. Acceptorul poate fi un atom care are o liberă orbitală, în acest exemplu, particula H +. s-orbitale libere cationilor + H ocupă doi electroni (i) un atom de oxigen.
Formarea Donor acceptor mecanism covalent legătură între molecule anorganice
Donor-acceptor de legătură mecanism covalentă este posibilă nu numai în tipul de interacțiune „atom-atom“ sau „moleculă-atom“, dar în reacțiile care apar între molecule. Singura cerință pentru interacțiunea donor-acceptor este cinetic molecule independente este o reducere a entropiei, cu alte cuvinte, mărind ordinea structurii chimice.
Să considerăm primul exemplu - formarea unui acizi aprotic (acizi Lewis) NH3 BF3. complex activ anorganic este format într-o reacție de adiție o molecula de amoniac și bor fluorură.
Electronii dintr-un atom de bor distribuite în următoarea ordine: 1s 2 2s 2 2p 1.
La excitarea unui electron comutatoare atom B de tip s la p-subnivel (1s 2s 1 2 2p 2). Astfel, atomul de bor extern excitat este doi și p s- doi electroni.
Molecula BF3 trei covalente bor-fluor B-F sunt formate de tip de schimb (atomi de bor și de fluor furnizează un electron). După formarea a trei legături covalente la atomul de bor la învelișul de electroni exterior rămâne liber p-subnivel, prin care molecula de bor fluor poate acționa ca un acceptor de electroni.
Electronii dintr-un atom de azot distribuit în următoarea ordine: 1s 2 2s 2 2p 3.
Trei electroni din atomi de N și H sunt implicate în formarea legăturilor de azot-hidrogen. După aceea, azotul rămâne încă doi electroni s-tip, care poate asigura lipirea mecanismului donor-acceptor.

În reacția trifluorura de bor și amoniac molecula NH3 acționează ca un donor de electroni și molecula BF3 - acceptor. O pereche de electroni de azot ocupă un orbital vacant de fluorură de bor și compusul chimic este format NH3 BF3.
Un alt exemplu al mecanismului de formare a legăturii donor-acceptor - obținerea polimer fluorură de beriliu.
Schematic, reacția este după cum urmează:
Electronii dintr-un atom sunt aranjate astfel Be - 1s 2s 2 2. atom și F - 1s 2s 2 2 5 2p.
Două fluor comunicarea beriliu fluorură de beriliu în molecula de tip schimbător de căldură covalente (implică două p-electroni ai celor doi atomi de fluor și doi electroni s-subnivel atom de beriliu).
Între o pereche de atomi de beriliu (Be) și fluor (F) sunt formate prin două legături mai multe covalente ale mecanismului donor-acceptor. Beriliu polimer atom de fluor fluorura - este un electron atom donor beriliu - acceptor lor având un orbital vacant.

Formarea donor acceptor mecanism covalent legătură între molecule organice
Atunci când există o conexiune, mecanismul de formare a subiectului între moleculele de natură organică, un compus complex format - complecși. In orice compus organic cu o legătură covalentă conținută ca ocupat (nonbinding și legare) sau orbitali goale (dezintegrare și non-obligatorie). Capacitatea formării complexului donor-acceptor este determinată de gradul de stabilitate a complexului, care depinde de forța de legătură.
Să considerăm un exemplu - reacția metilaminei cu interacțiunea moleculei cu acid clorhidric pentru a forma clorura de amoniu metil. In toate conexiune metilamina molecule covalente formate la mecanismul de schimb - două legături H-N legătura și un N-CH3. După ce compusul cu hidrogen și o grupare metil la atomul de azot este o pereche de electroni s-type. Ca donator, acesta oferă perechea de electroni a atomului de hidrogen (acceptor), care are un orbital liber.

Mecanismul donor acceptor fără să formeze o legătură chimică
Nu în toate cazurile, interacțiunea donor-acceptor are loc formarea de socializare și de electroni de legătură pereche. Anumiți compuși organici pot fi combinate între ele datorită suprapunerii donatorului orbitali umplut cu orbital gol unui acceptor. de transfer de sarcină are loc - electroni între donor și acceptor, situate foarte aproape una de alta delocalizat. format complexe cu transfer de sarcină (CTC).
O astfel de interacțiune este caracteristic pentru sistemele pi, care sunt ușor de suprapunere orbitale, iar electronii sunt ușor de polarizat. Rolul donatorilor poate acționa metaloceni, compus amino nesaturat, TDAE (tetrakis (dimetilamino) etilenă). Acceptors sunt adesea fullerene quinodimethane având substituenți acceptoare.
Transferul de încărcare poate fi fie parțială sau totală. Transfer de încărcare completă se produce în timpul photoexcitation a moleculei. Aceasta formează un complex, care poate fi observată spectral.
Indiferent de caracterul complet al transferului de încărcare, astfel de complexe sunt instabile. Pentru a crește puterea și durata de viață a unui astfel de stare introducerea in continuare a unui grup de legătură. Ca rezultat al sistemului donor-acceptor utilizat cu succes în dispozitivele de conversie a energiei solare.
In anumite bond molecule organice pe mecanismul donor-acceptor este format în moleculă între grupul donor și acceptor. Acest tip de interacțiune este numit efect transannular caracteristic, de exemplu, pentru Atrani (compuși organometalici cu conexiuni N-> B, N-> Si).
bond semipolar sau mecanism de formare a legăturii dativ
Mai mult schimbul și donor-acceptor există treilea mecanism - dativ (alte nume - semipolar, semipolar sau obligațiuni de coordonare). donator Atom oferă pereche liberă de electroni pe orbital atomului neutru care are nevoie de doi electroni pentru a termina nivelul exterior. Este un fel de tranziție de densitate de electroni de la donator la acceptor. În acest caz, donatorul devine încărcat pozitiv (cation) și un acceptor - încărcat negativ (anionic).
De fapt, legătura chimică este formată prin legarea shell (suprapunere doi electroni pereche de la un atom de altul liber exterior orbital) și atracția electrostatică generată între cation și anion. Astfel, într-o legătură covalentă și semipolar tipuri ionice combinate. caracteristică a legăturii semipolar-elemente d, care sunt compuși diferiți pot juca un rol și acceptor și donor. In cele mai multe cazuri, apare într-un complex de substanțe și organice.
Exemple de dativ comunicare
Cel mai simplu exemplu - o molecula de clor. Un atom de Cl trimite o pereche de electroni la un alt atom de clor, care este liber d-orbital. Astfel, un atom de CI este încărcat pozitiv, celălalt - negativ, și electrostatice atracția are loc între ele. Datorită marii lungimea legăturii dativ este mai slabă în comparație cu schimbul covalent și-acceptor de tip donor, dar prezența sa crește puterea de molecule de clor. De aceea, molecula Cl2 este mai stabil decât F2 (nici un atom de fluor la d-orbitali, comunicare fluor-fluor numai schimb covalent).
Molecula de monoxid de carbon CO (monoxid de carbon) este format prin trei legături CO. Deoarece oxigen și atomii de carbon are la exterior două singur electron, formând două covalente de cuplare; schimb. După aceasta, atomul de carbon rămâne vacant orbital într-un atom de O - două perechi de electroni la nivelul exterior. Prin urmare, în molecula, monoxid de carbon (II) au oa treia conexiune - semipolar fiind format prin pereche doi electroni de valență ale oxigenului și orbitali de carbon liber.
Să considerăm mai complicat exemplu - formarea acestui tip de comunicare, de exemplu, interacțiune dimetil eter (H3C-O-CH3), cu clorură de aluminiu AICI3. un atom de oxigen în DME legat prin legături covalente cu două grupe metil. După aceea, el a plecat cu încă doi electroni p-subnivel, care dă un atom acceptor (aluminiu) și devine cation pozitiv. Astfel atom acceptor capătă o sarcină negativă (anion se întoarce la). Cation și anion interacționează unele cu altele electrostatică.
Înțeles legătură donor-acceptor
Mecanismul de formare a unei legături donor-acceptor este esențială pentru viața umană și este larg distribuită în compuși chimici atât de natură organică și anorganică, așa cum se confirmă prin exemplele discutate mai sus. Amoniacul, ca parte a, care are un cation de amoniu, a fost aplicat cu succes în viața de zi cu zi, medicină, și producția industrială de îngrășăminte. Hidroniu ion joacă un rol major în dizolvarea acidului în apă. Monoxidul de carbon utilizat în industrie (de exemplu, în producția de îngrășăminte, sisteme laser) și este de mare importanță în sistemele fiziologice ale organismului uman.
