Energia internă a fluidului de lucru, fără termen, lucrări de eseuri și disertații
Energia internă a oricărui corp fizic se referă la proprietățile fundamentale ale materiei din care cuprinde corpul. Acesta este definit ca o funcție de variabile de stat și, prin urmare, se numește o funcție de stat.
Energia internă bazată pe teoria de gaz real cinetică include:
-energia cinetică de translație, rotație și vibrație
-potențialul energetic al particulelor de interacțiune
-energia cochilii de electroni de atomi;
În cele mai multe dintre ultimele două componente ale proceselor de putere termică rămân neschimbate. De aceea, în cele ce urmează, prin energia internă a gazului ne referim la energie a mișcării aleatoare de molecule și atomi, care cuprinde energia cinetică a translatie, mișcările de rotație și oscilatorii ambele tip molecular și intramoleculare, precum energia potențială a forțelor de interacțiune între pereche ...
molecule.
Energia cinetică a moleculelor este o funcție de temperatură, valoarea potențială depinde de distanța medie dintre moleculele și deci energia este o funcție a volumului specific v. U energia internă a unui gaz ideal, care nu are forța de interacțiune dintre moleculele nu depinde de volumul sau presiunea gazului, așa cum este determinat de temperatura.
Valoarea energiei potențiale care apare într-o interacțiune Pairwise de molecule, depinde de distanța medie dintre molecule și, prin urmare, este o funcție a volumului specific v.
U energia internă a unui gaz ideal. în care nici o forță de interacțiune dintre moleculele nu depinde de volumul sau presiunea gazului, așa cum este determinat de temperatura.
La T = 0 este stocată numai în atomii și electronii ext mișcare. NEE. în același timp, se numește energie internă zero.
Astfel, o energie internă complet poate fi scris:
în cazul în care UKIN și UP0T - energia cinetică și potențială internă a moleculelor;
Uo - energia internă a corpului la o temperatură de zero absolut.
Astfel, la T = 0, energia cinetică și potențială
mișcare termică a moleculelor este egal cu zero, dar rămâne de energie de origine non-termică (mișcarea electronilor intranucleari proceselor și t. d.).
În termodinamică, studiul este doar fenomenul de origine termică, astfel încât se presupune că Uo = 0.
Folosind ecuația ecuației de stare poate Uvyrazit prin oricare doi parametri, adică,
În cazul în care expresia de a diferenția, descoperim că Uyavlyaetsya diferențială totală a oricăror două variabile de stat, cum ar fi
Această proprietate este diferită de lucrarea (și de căldură, așa cum va fi prezentat mai jos), care nu este o funcție a stării sistemului,
Pentru un sistem complex, format dintr-un amestec de gaze, este determinată de suma energiilor pieselor individuale, adică. E. Are aditivitatea proprietate.
Deoarece totalul parametrilor de stare diferențială Uyavlyaetsya, energia internă a sistemului va fi starea parametrului:
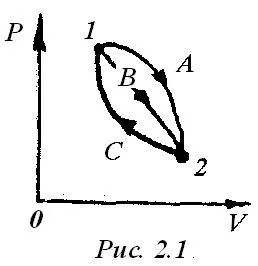
Schimbarea procesului termodinamic Ub nu depinde de natura căii (A, B sau C) și este determinată numai de starea inițială și finală a procesului de la punctele 1 și 2, (Fig.2.1), adică
De energiiravno interne specifice de variație proces ciclic zero.
Teoria cinetică moleculară a gazelor se dovedește că, într-un gaz ideal este nici o interacțiune între moleculele, energia internă este independentă de P și v. și este numai o funcție a temperaturii:
Spre deosebire de energia internă a funcției de căldură sau de exploatare nu este totală diferențialele, și, prin urmare, punerea în aplicare a procesului depinde nu numai de valorile inițiale și finale ale funcției, dar, de asemenea, să ia în considerare natura procesului (de exemplu, starea parametrilor modificați) .Vsledstvie această
energie internă, atribuită unității de masă, numită energia internă specifică. u = U / m [J / kg].
Pentru probleme tehnice ale termodinamicii este important să nu valoarea absolută a energiei interne și modificarea acesteia în diferite procese termodinamice. Prin urmare, energia internă a originii poate fi selectată în mod arbitrar.
De exemplu, în conformitate cu valoarea acordului internațional a energiei interne este luată ca zero pentru apă la o temperatură de 0,01 ° C și o presiune de abur saturat la această temperatură 610.8 Pa, iar pentru gaze ideale la O ° C, este o funcție a presiunii.
În continuare se va numi pur și simplu amploarea și energia internă pentru concizie.
Diferențiala energiei interne este egală cu
unde cv - adevărata capacitate de masă specifică de căldură la volum constant, T - temperatura fluidului de lucru.
În calcule practice creșterea energiei interne determinată prin formula
în care - capacitatea medie de căldură la volum constant în intervalul de temperatură de t1 și t2.