Electroliza unei soluții apoase de clorură de sodiu
procese chimice sub un curent constant și o electrochimică numită electron izolant. Conform primei legi a lui Faraday, masa substanțelor precipitate pe electrozii direct proporțional-ționale cu cantitatea de energie electrică a trecut prin electrolit.
Conform celei de a doua lege a lui Faraday, același număr de elektrichest-wa trece prin electrolit, electrodul va sta greutăți echivalente ale diferitelor substanțe, adică pentru a izola electrodul de un furaj echivalent toate substanțele necesare pentru a consuma aceeași cantitate de electroni trichestva (96.500 coulombi), denumit număr Faraday (F).
Cl F = 96500 = 26,8 (amper oră).
Masa teoretică a substanței poate fi calculată conform formulei, uniunea sculpta legea lui Faraday doi:
# 964; - durata electrolizei, o oră;
A - ion de masă, g / mol;
Numărul Faraday, CI - F;
E - echivalent electrochimic, g / Cl.
Obiectiv: Pentru a obține clor și hidrogen prin electroliza clorurii de sodiu sol-ra apos și clorură de sodiu este utilizat pentru obținerea unui înălbitor. Pentru a investiga soluția după electroliza.
Reactivi: soluție saturată de NaCl, uscat Ca (OH) 2. KI, soluție de amidon, turnesol, fenolftaleina, magenta.
Echipamente: celulă în formă de U, cu un azbest poros re-Hyvinkää, anod de carbon, un catod de fier, îndreptați-Tel, ampermetru, voltmetru, un set de fire, tub de cauciuc, un tub de clorură de calciu, eprubete, chibrituri lu-rank.
Lucrările în curs de desfășurare: colecta instalația conform schemei prezentate în figura 1.
Celula electrolitică este turnat o soluție de clorură de sodiu. Tubul de clorură de calciu turnat 2 g de var stins și este atașat la celulă. Clorul care trece printr-un tub de clorură de calciu, reacționează cu var stins conform ecuației:
Inițial clor masa calculată necesară pentru reacția cu 2 g de var stins. În conformitate cu greutatea calculată a clorului-Ness determinat electroliza prelungită la un curent de 1 amper sau 2 conform ecuației (1). Apoi, includ dispozitivul în rețea și electroliza se realizează în timpul calculat, colectarea simultană a hidrogenului în eprubetă și testarea acestuia. După over-consummate dispozitiv operație de dezactivare, un tub de clorură de calciu este deconectată și înălbitor rezultată este verificată pentru prezența clorului activ. Pentru această parte a pulberii de var cu o soluție de iodură de potasiu și soluție de amidon flow-vayut.
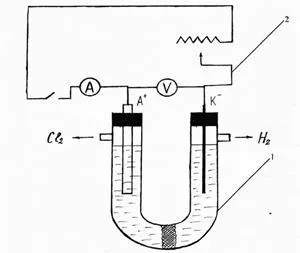
Fig. 1. Aparat pentru electroliza clorurii de sodiu
celulă de electroliză cu azbest septum poros - 1; 2 - In-redresor 24M.
explorarea în continuare compartimentul anodic și catod asupra pH-ului. Sensibil de-tuburi de turnare de 2-3 ml de catod și anod spațiu și de a le mări indicatorul corespunzător.
Efectuarea rezultatelor.
1. Scrieți ecuația reacțiilor de electroliză și a produselor pe dovezi-TION obținute.
2. Furnizarea de calculele necesare.
3. Vă rugăm să descrieți fenomenele observate.
Laborator № 5