Economisirea energiei pe membranele
Împreună cu compuși de energie altă acumulare de energie loc chimic sunt membranele biologice. Tehnica de funcționare a sistemului, prin separarea sarcinilor electrice strat neconductive, numit condensator. Conform principiului funcției condensator biomembrane, separarea stratului izolator atomi si molecule (ioni) încărcate în mod similar.
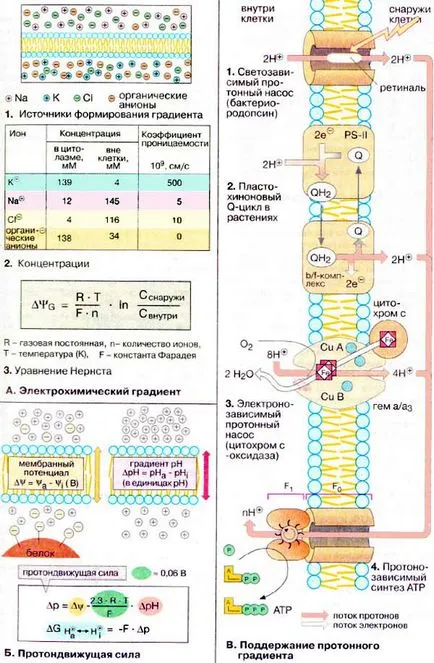
A. electrochimică Gradientul
In timp ce membrane lipidice artificiale la ionii cu greu membranele biologice permeabile conțin „canale ionice“, prin care ionii individuali la impregnind selectiv prin membrana (vezi. P. 220). Permeabilitatea membranei și polaritatea depinde de gradientul electrochimic. t. e. din concentrațiile de ioni de pe ambele părți ale membranei (gradientul de concentrație) și de către o diferență de potențial electric între fețele interioare și exterioare ale membranei (potențialul de membrană).
In repaus potentialul de membrana celulelor (potențial de repaus. Cm. P. 340) este -0.05--0.09 V, adică pe partea interioară a membranei plasmatice predomina sarcini negative in exces. potențial de repaus este asigurată în primul rând de cationi de Na + și K +. precum și anioni organici și ioni de Cl - (1). Concentrații în interiorul și în afara celulelor și coeficienți de permeabilitate ale acestor ioni sunt prezentate în tabelul (2).
Distribuția ionilor între mediul extern și volumul intern al celulei este descrisă de ecuația Nernst (3), în cazul în care # 916; # 936; G - potențial transmembranar (în volți, V), adică, o diferență de potențial electric între cele două părți ale membranei, în lipsa transportului de ioni prin membrană (potențialul de echilibru). Pentru ionii monovalenți la temperatura de 25 ° C factor RT / Fn este egal cu 0,026 V. Cu toate acestea, tabelul (2) Rezultă că pentru K + ioni # 916; # 936; G este aproximativ egală cu -0.09 V, adică, cantitatea de același ordin ca și potențialul de repaus ... Pentru ionii de Na +. dimpotrivă, # 916; # 936; G = +0,07 V, adică mai mare decât potențialul de repaus. Prin urmare, ionii de Na + intra în celulă la deschiderea Na + -Canal (vezi. P. 340). Concentrațiile Inegalitatea de ioni de Na + și K + menținut constant Na + / K + -ATP-azei în cheltuielile de ATP (vezi. P. 222).
B. forță motrice de protoni
ioni hidroniu ( «H + -ions") pot forma, de asemenea, un gradient electrochimic. Acest gradient de protoni este crucial pentru sinteza ATP celulare (vezi. P. 142). Ca și în cazul altor ioni. transfer de protoni de energie liberă (diferența dintre potențialul electrochimic de protoni la cele două părți ale membranei) depinde de gradientul de concentrație. .. Ie diferența de pH (# 916; pH) pe fiecare parte a membranei. Mai mult decât atât, ceea ce face o anumită contribuție și potențialul transmembranar # 916; # 936; (Cm. A). Ambele valori formează forța motrice de protoni # 916; p, care este o măsură a muncii # 916; # 936; G. care poate face gradientului H +. Astfel, gradientul de protoni prin membrana mitocondrială interior (vezi. P. 144) dă aproximativ 24 kJ per mol de transferat ionilor H +.
V. gradient de protoni Menținerea
gradient de protoni format în diferite moduri. Este neobișnuit bacteriorodopsină pompei de protoni (1), folosind energia luminii (a se vedea. P. 130). In timpul fotosintezei (vezi. P. 134) plastoquinone redus (QH2) transportă protoni cu electroni prin membrana (Q-bucla 2). Formarea unui gradient de protoni în lanțul respirator (vezi. P. 142) este de asemenea asociat cu un proces redox. Complexul III, probabil ca în fotosinteză. Alerga responsabil pentru transferul de Q-inel (nu este prezentat). Citocromul c oxidaza (complexul IV, 3) H + -transport conjugat cu fasciculul de electroni de la citocromului c pentru O2.
In fiecare dintre aceste cazuri, gradientul de protoni este utilizat în sinteza ATP din ATP sintaza (4). ATP sintaza este format din două componente: un canal de proton (F0) și controlat printr-un complex de proteine (F1), care transformă fluxul de energie de protoni prin membrană în energie chimică a ATP (144 cm ..).
