drept periodic în formularea modernă
Distribuiți prietenilor:
drept periodic în formularea modernă. Sistemul periodic. fizic
sensul legii periodice. Structura sistemului periodic. Schimbarea proprietăților atomilor
elemente chimice grup principal. Planurile de un element chimic.
drept periodic în formularea modernă:
Proprietățile substanțelor simple, și forma și proprietățile compușilor elementelor găsite în tabelul periodic, în funcție de sarcina nucleului (= număr atomic)
Sistemul periodic:
Tabelul periodic: este o reprezentare grafică a legii periodice.
Sensul fizic al legii periodice:
Schimbarea periodică a proprietăților elementelor chimice și compușii acestora în încărcătura tot mai mare a nucleului atomului, datorită faptului că structura stratului electronic exterior al atomilor elementelor repetate periodic.
Structura sistemului periodic al elementelor chimice:
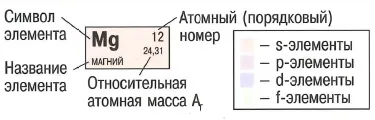
- Fiecare element chimic este reprezentat printr-un simbol și ocupă o celulă, care prezintă unele dintre proprietățile sale.
- Numărul atomic: numărul de protoni = electroni
- Relativă greutate atomică: raportul în greutate este 1/12 atom la atomul de carbon de masa atomica. Valoarea Rotunjit egal cu numărul total de protoni și neutroni.
- Perioada: un element din seria orizontale, aranjate în ordinea sarcina lor nucleu atomic ascendent. Atomii elementelor din aceeași perioadă au același număr de cochilii de electroni ocupate.
- perioade scurte (1, 2, 3) constau dintr-un rând orizontal
- perioade mari (4-7) constau din două rânduri orizontale
- Perioadă: arată numărul de nivele de energie de electroni ocupate în atomii elementelor care aparțin acestei perioade corespunde numărului de ultimul nivel electronic, în cazul în care există cel puțin un electron
- Începutul fiecărei perioade coincide cu începutul unui nou strat de umplere electronic.
- Fiecare perioadă începe elementul al cărui atomi formează din metal substanță, dar membru final, atomii care formează un inert (= nobil) gaz
- Grupa: Această coloană verticală a elementelor ale căror atomi au același număr de electroni de valență. Fiecare grup este format din principal (A) și partea (B) subgrupe.
- Subgrupurile formate elemente cu proprietăți similare.
- Numărul grupului indică numărul de electroni de valență în atomii elementelor care aparțin grupului. Numărul de grup pentru elementele perioadelor de 2 și 3 indică numărul de electroni în ultimul nivel electronic.
- Acasă subgrup conține elemente ale ambelor perioade mici și mari. subgrup incidental conține elemente numai pe perioade mari.