Cum de a găsi o masă moleculară relativă
Masă moleculară relativă a substanței (sau pur și simplu - greutate moleculară) - raportul dintre masa substanței 1/12 masa unui atom de carbon masa moleculară (C) .Nayti relativ foarte ușor.
veți avea nevoie de
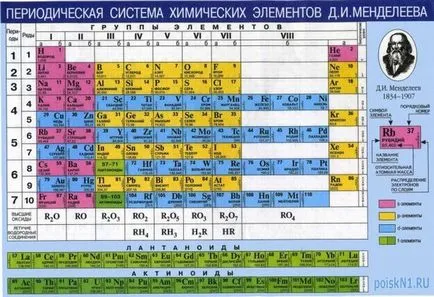
- Tabelul periodic și greutatea moleculară Tabelul
instrucție
Masa moleculară relativă a substanței - este suma maselor atomice. Pentru a găsi greutatea atomică a unui element chimic, doar uita-te la tabelul periodic. Acesta poate fi găsit pe coperta orice manual de chimie, sau disponibile separat într-o librărie. Pentru studentul este destul de adecvat versiunea de buzunar, sau o foaie de hârtie A4. Orice birou modern este echipat cu un perete de chimie pe scară largă a tabelului periodic.
Audierea elementul masă atomică, este posibil să se înceapă calculul și greutatea moleculară a substanței. Acest lucru este cel mai ușor de ilustrat un exemplu:
Necesar pentru calcularea masei moleculare a apei (H2O). Din formula moleculară arată că molecula de apă este format din doi atomi de oxigen și un atom de H hidrogen O. Prin urmare, calculul greutății moleculare a apei poate fi redusă la acțiunea:
* 2 + 1,008 16 = 18,016
În plus față de metoda de mai sus, datele privind greutatea moleculară a anumitor compuși chimici pot fi evidențiate în greutăți moleculare de masă.
Atomică de masă a apărut ca un concept în 1803, datorită lucrărilor de bine-cunoscute la momentul chimistul Dzhona Daltona. La acea vreme masa oricărui atom comparativ cu masa unui atom de hidrogen. Dezvoltarea în continuare a acestui concept a fost în lucrările unui alt chimist - Berzelius, în 1818, când a propus utilizarea unui atom de oxigen în loc de un atom de hidrogen. Din 1961, chimiștii toate țările au adoptat unitatea de masa atomică a 1/16 din masa atomului de oxigen, sau 1/12 masa unui atom de carbon. Acesta din urmă este indicat cu precizie în tabelul elementelor chimice ale lui Mendeleev.
Când se utilizează tabelul periodic, în forma în care este furnizat în cele mai multe manuale de chimie și alte referințe, ar trebui să se înțeleagă că acest tabel este o versiune prescurtată a tabelului periodic original. În forma sa cea mai mare, fiecare element chimic este dedicat o linie separată.
Atenție, numai azi!