Covalentă nepolară și legături polare
perechi de electroni comune în produse în substanțe simple, 2. O 2. H CI F 2. 2. 2. N aparțin în mod egal ambelor atomi. Aceasta se numește non-polare legătură covalentă.
legătură covalentă nepolară leagă atomii de substanțe simple, nemetale.
Dacă se formează o legătură covalentă între diferiți atomi, totalul deplasărilor pereche de electroni la una care are o electronegativitate mai mare (EO). El devine o sarcină negativă parțială. Atom având un EO mai mic devine de încărcat pozitiv. În acest caz, o legătură covalentă polară.
legătură covalentă polară se formează între atomii nemetalice din substanțele complexe.
Luați în considerare formarea de legături covalente în substanțe complexe.
1. Formarea moleculei de acid clorhidric
În atomul de hidrogen la nivel extern, un electron. Clorul extern șapte electroni, unul nepereche.
A format o pereche de electroni comune, care este decalat față de atomul de clor. Ca rezultat,
apar modificări parțiale: un atom de clor negativ și atomul de hidrogen - pozitiv. schimbarea densității de electroni este de obicei notată cu litere grecesc ö delta:
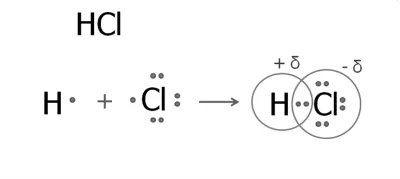
Clorură structurală formula H - Cl.
atomi în moleculele altor halogenuri conectate În mod similar:
H - F H - Br H - I
2. Formarea unei molecule de apă
Pe plan extern, șase electroni ai atomului de oxigen, dintre care două sunt nepereche.
atom de oxigen formează două perechi de electroni împarte cu doi atomi de hidrogen.
Densitatea de electroni a acestor perechi comune mutat la mai mult oxigen electronegative. atom de oxigen are o sarcină negativă, iar atomii de hidrogen - pozitiv.
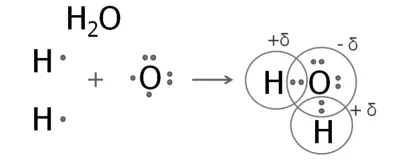
O structură similară are o molecula de hidrogen sulfurat. Formulele structurale ale apei și hidrogen sulfurat:
H - O H - S | | H H
3. Formarea moleculelor de amoniac
La un atom de azot cinci electroni exterioare, dintre care trei nepereche.
Atomul de azot se ataseaza la trei atomi de hidrogen.
Azot - element de mai electronegative, deci va fi un atom de sarcină negativă, și atomi de hidrogen - încărcare pozitivă.
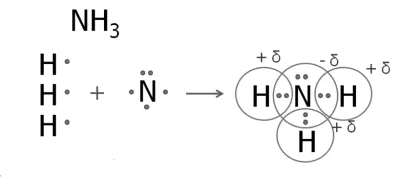
Este de asemenea produs din cauza fosfina. Formulele structurale ale amoniacului și fosfină:
H - N - H H - P - H | | H H
Pentru a determina semnele parțiale ale taxelor asupra atomilor din material, este necesar să se compare EA nemetale.
Definim sarcinile parțiale ale atomilor din compusul C Cl 4.
Să ne amintim poziția carbonului și clor printre EO:
F O N CI Br S C
Poziția elementelor din acest rând arată că mai multe elemente electronegative este în această pereche clor. Atom ea se trage la perechile de electroni generale de atomi de carbon. Aceasta înseamnă că un atom de clor este o sarcină negativă parțială la un atom de carbon și - un efect pozitiv parțial:
C + δ Cl 4 - δ