concentrațiile soluției Recalculare
Exemplul 1: Cât de mulți mililitri de soluție de acid sulfuric cu o fracție de masă de 0,96 densitate 1,84 g / ml este necesară pentru a prepara 500 ml de 0,5N. soluție.
Decizie. Masa molară a acidului sulfuric
Molar greutate echivalentă: Mack (H2 SO4) = 98 • 1/2 = 49 g / mol.
Am găsit greutatea de acid sulfuric conținute în 500 ml de 0,5N. soluţie:
Gasim greutate soluție de acid sulfuric 96% conținând m (H2 SO4) = 12,25 g
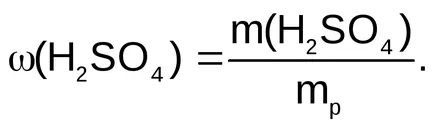
Am găsit volumul de soluție de acid sulfuric 96% greutate de 12,76 g
Astfel, pentru a prepara 500 ml de 0,5N. Soluție de acid sulfuric necesară 6,9 ml de soluție de acid sulfuric cu o fracție de masă de 0,96.
Exemplul 2. Densitatea 0,5M soluție de carbonat de sodiu a fost de 1,05 g / ml. Se calculează fracțiunea de masă a Na2 CO3. soluție Titrul, concentrația molară echivalentă și soluție molalitate.
Decizie. Acceptați 1 l soluție. Concentrația molară a soluției CO3 0,5M Na2. Prin urmare, în 1 litru de soluție conținea 0,5 mol de Na2 CO3. Vor găsi toate informațiile necesare pentru calcularea concentrațiilor.
Greutatea soluției: mp = Vp • ; mp = 1000 • 1050 = 1,05
masa molara: M (Na2 CO3) = 106 g / mol.
Factor de echivalență FEK (Na2 CO3) = 1/2.
greutate echivalentă Molar:
Cantitatea de substanță: n (CO3 Na2) = 0,5 mol.
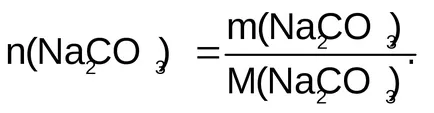
cantitate echivalentă de substanță:
m (H2O) = 1050 - 53 = 997 g = 0,997 kg.
Găsiți fracțiunea de masă de CO3 solut Na2.
Acest lucru înseamnă că, în 100 g de soluție conținea 5 g de Na2 CO3. Titrul găsi o soluție:
Acest lucru înseamnă că, în 1 ml de soluție conține 0,053 g de Na2 CO3.
Găsiți concentrațiile molare echivalente:
Acest lucru înseamnă că în 1 litru de soluție conținea 1 mol de Na2 CO3.
Găsim concentrația molal
Aceasta înseamnă că 0.502 mol de Na2 CO3 conținute în 1 kg H 2 O.
5.2. disociere electrolitica
molecule Dezintegrarea electrolitice în ioni sub influența moleculelor de solvent polar numit elektroliticheskoydissotsiatsiey. soluții apoase Substanțe sau topituri care conduc electricitatea sunt denumite electroliti.
Acestea includ apă, acizi, baze și săruri. Când se dizolvă în apă, moleculele de electroliți disociază în ioni pozitivi - cationi și negativi - anioni. Procesul de disociere electrolitica datorită interacțiunii substanțelor cu apă sau alt solvent, rezultând în formarea ionilor hidratați.
Astfel, un ion de hidrogen ion formă hidroniu:
Pentru a simplifica ionul hidroniu este înregistrată fără molecule de apă, adică H +.
sau de intrare acceptate: NaCI Na + + Cl -.
Disocierea acizi, baze, săruri
Acizii numit electroliți care se disociază pentru a forma cationi ca cationilor de hidrogen. De exemplu,
trepte de disociere acidă polibazici. De exemplu, acidul hydrosulphuric disociază pași:
H2 S H + + HS - (prima etapă)
HS - H + + S 2- (a doua etapă)
Acizii polibazici disocierii se desfășoară în principal în prima etapă. Acest lucru se datorează faptului că energia care trebuie cheltuite pentru separarea ionilor de molecule neutre. este minimă și devine mai mare atunci când disociere pentru fiecare etapă următoare.
Baze numite electroliți care se disociază în soluție pentru a forma un anion ca numai hidroxid de ioni. De exemplu,
Mnogokislotnye disocia de bază în trepte
Mg (OH) 2 MgOH + + OH - (prima etapă)
MgOH + 2+ + Mg OH - (a doua etapă)
Acid Stepped și disociere de bază explică formarea de săruri acide și bazice.
Sunt electroliții care disociază în același timp, ca majore și ca acid. Acestea se numesc amfoter.
H + + RO - ROH R + + OH -
Amfoter explicat rezistență mică legătură diferența R-H și O-H.
Prin electroliții amfoteri includ apa, hidroxizi de zinc, aluminiu, crom (III), staniu (II, IV), plumb (II, IV), și altele.
Disocierea hidroxid amfoter, cum ar fi Sn (OH) 2. poate fi exprimată prin ecuația: