Clasificarea reacțiilor complexe
Cele mai multe reacții chimice care au loc în lumea din jurul nostru și utilizate în industrie sunt complexe. În funcție de mecanismul, acestea sunt împărțite în reversibil, paralel, serial, conjugat cu lanț.
Pentru reacțiile reversibile sunt că, în condițiile date pot să apară spontan atât înainte și direcția inversă. În general, ecuația chimică reacție reversibilă este scris după cum urmează:
unde a, b, c, d, .... - coeficienți stoichiometrice ale sursei formule (A, B, ....) Și (C, D, ...) substanțele finale.
Un exemplu al unui proces reversibil care apar în organismele vii, poate servi ca o reacție de esterificare:
așa cum este utilizat în industrie - sinteza amoniacului din azot și hidrogen:
Viteza reacției reversibile este diferența dintre ratele forward și reacții inverse.
Reacțiile paralele sunt numite reacție de tip:
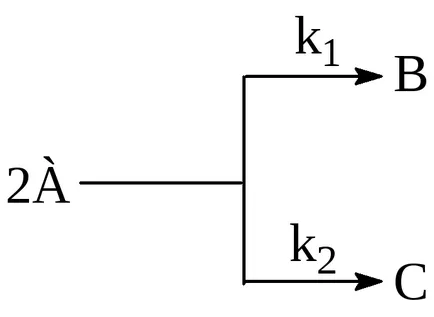
și anume în care aceleași materii prime în timp ce reacționează unul cu celălalt pentru a forma produse diferite.
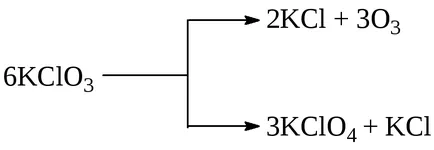
Un exemplu de acest tip de reacție este reacția de descompunere sării cloratul KClO3. capabil să curgă în anumite condiții, în două direcții
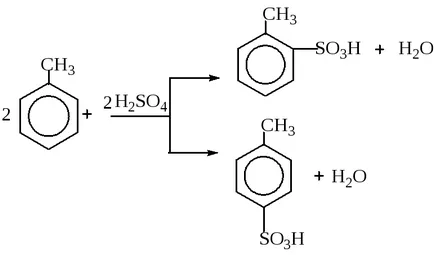
În paralel, două sau mai multe mecanisme pot curge dezintegrarea nucleelor atomice ale unor elemente radioactive. Foarte adesea reacții paralele apar în chimia organică. De exemplu, dacă sulfonarea de acid sulfuric toluen pot fi formate simultan parasulfoproizvodnye orto- și:
În unele cazuri, pot fi reacții paralele și biochimice în celulele organismelor vii. De exemplu, fermentarea enzimatică a glucozei:
1) C6 H12 O6
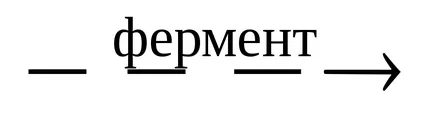
2) C6 H12 O6
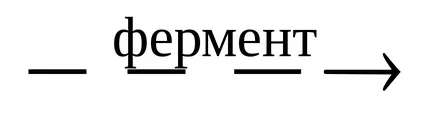
În anumite condiții, multe reacții paralele pot să apară în principal, numai într-o anumită direcție.
viteză de reacție paralelă este determinată de cel mai rapid stadiul de viteză.
Sunt acele reacții succesive, în care formarea produsului final, din materiile prime nu este direct și în mod necesar prin mai multe etape intermediare care se desfășoară una după alta într-o secvență strict definită. Schematic, un astfel de proces poate fi descrisă după cum urmează:
unde fiecare literă desemnează un pas proces separat. În general, numărul de etape în reacțiile secvențiale pot fi foarte diferite (de la câteva la câteva zeci). Mai mult decât atât, fiecare dintre etapele, la rândul său, nu este în mod necesar un mono- simple sau de reacție bimolecuă, dar poate fi dificil.
Reacțiile secvențiale sunt foarte frecvente în natură și de foarte multe ori acestea sunt observate în procesele biochimice care au loc în organisme vii, plante. Ca exemple de astfel de reacții pot provoca fotosinteză și oxidarea biologică a glucozei, hidroliza oligo- și polizaharide, etc.
Calcularea cineticii reacțiilor secvențiale este foarte complexă și poate fi destul de precis Implementarea unui proces relativ simplu, constând dintr-un număr mic de trepte.
Cu toate acestea, în cazul în care una dintre etapele de reacție consecutive are o viteză semnificativ mai mică decât restul, rata globală de reacție va fi determinată de rata acestui pas special, care în acest caz nazyvaetsyalimitiruyuschey.
De exemplu, reacția de clorurare a oxidului de azot (II)
Se compune din două etape:
2) NOCl2 + NO = 2NOCl
Prima etapă este rapidă, cu formarea produsului NOCl2 instabil. A doua etapă este lentă și de limitare. în toată viteza de reacție este descrisă de o ecuație cinetică
și procedura generală pentru această reacție este de 2.
Conjugat menționat reacțiile desfășoară conform următoarei scheme:
Unul dintre aceste reacții pot apoi să apară în mod independent, iar a doua reacție este posibilă numai în prezența primului. Astfel, fluxul de o reacție inițiază oa doua implementare.
Conjugat posibile reacții în biochimie. Ele apar in celule, cu energia necesară pentru curgerea unei a doua reacție cu ΔG2> 0, dă prima reacție, pentru care ΔG1 <0. Причём │ΔG1 │> │ΔG2 │, și anume întregul proces are loc cu o scădere a energiei Gibbs. Aceste reacții biochimice sunt numite inachetandemnymi.
Adesea, reacțiile mecanism de conjugat este formarea particulelor intermediare active, care sunt responsabile de apariția lor.
Circuit cuplate reacții de acest tip pot fi reprezentate, în general, după cum urmează:
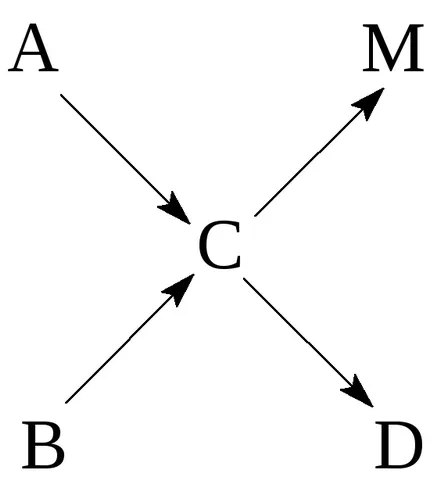
unde C - particule intermediare activ.
De exemplu, benzen într-o soluție apoasă de H2 O2 nu este oxidat. dar atunci când se adaugă o sare feroasă este transformarea sa în fenol și difenil. Pentru a „porni procesul ionyFe 2+ întâi reacționează cu H2 O2. Radicalii care formează · OH
care reacționează apoi cu benzen ca și
Fe 2+ + ∙ OH → Fe 3+ + OH -
Fenomenul inducției chimice a fost investigat pentru prima dată de NA Șilov 1905
reacții chimice în lanț numit printr-o serie proceda de repetarea cu regularitate etape elementare care implică specii active, care conțin în componența sa atomii cu electroni nepereche în nivelul energetic exterior (sau alte - radicali liberi).
lanț K sunt reacții de combustie de polimerizare și policondensare dezintegrarea nucleelor și altele.
Mecanismul reacțiilor în lanț este faptul că radicalii liberi (adesea în rolul lor ies singur atom) au o activitate chimică ridicată. Ei reacționează ușor cu molecule stabile și să le transforme în particule active, care apoi formează produși de reacție și radicali noi și, astfel, există un lanț de măsuri suplimentare. Reacția în lanț continuă până când toată substanța a reacționat sau până când nu mai activ particule radicali.
Pentru reacțiile în lanț caracterizate prin trei etape: 1) lanț nucleată; 2) dezvoltarea unui lanț sau înălțimea ei; 3) un circuit deschis.
lanț Limbo începe cu un act chimic elementar, rezultând în particula activă formațiune. Acest proces necesită energie și poate fi o substanță sub încălzire, expunerea la radiații, acțiunea catalizatorului ionizanta.
De exemplu, în reacția de sinteză a acidului clorhidric și clor și hidrogen care curge printr-un mecanism cu lanț (H2 + Cl2 = 2HCI) Circuit corespunde la apariția procesului
Circuit de dezvoltare este o repetare periodică a etape de reacție, cu radicalii formați. Acestea sunt cunoscute sub denumirea de link-uri de lanț:
Lungimea lanțului de determinat de numărul de molecule de materie primă a reacționat într-un singur act de lanț nucleaŃie, înainte de terminarea ei.
Particularitățile stadiului de dezvoltare a reacțiilor în lanț sunt împărțite în irazvetvlonnye neramificată. În primul caz, cantitatea de particule active, radicali liberi rămâne constantă pe parcursul acestei faze.
Reacțiile în lanț ramificat de curgere unul particule active conduce la formarea de multiple (două sau mai multe) alte particule active. Schematic poate fi reprezentat după cum urmează:
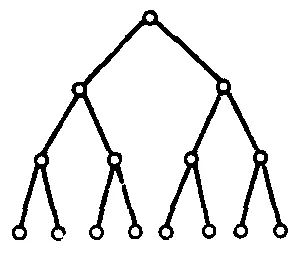
Circuit deschis corespunde dispariției speciilor active, ca rezultat al interacțiunii cu celălalt:
Mai mult, poate să apară la adsorbție particulelor pereților vaselor după ciocnire a două particule active cu al treilea (denumit inhibitor), în care specia activă este dat un exces de energie. Prin urmare, pentru reacții în lanț dependența tipică a ratei de mărimea, forma și materialul din vasul de reacție, prezența substanțelor inerte străine care acționează ca un inhibitor.
Reacțiile în lanț neramificat de viteză determinată de viteza de cel mai lent etapă, adică nașterea lanțului. Pentru fiecare etapă în reacții de acest tip, folosind cinetica chimică convenționale ecuații (primul sau al doilea ordin).
reacții chimice ramificați pot apărea pe legea cinetică complexă și nu are o anumită ordine. Radicalii „Propagarea“ în ea de multe ori duce la o cascadă de flux de proces, care provoacă o explozie. Cu toate acestea, în aceste reacții este posibil eșec de circuit. Prin urmare, o creștere rapidă a vitezei procesului (până la explozie), are loc în cazul în care rata de ramificare, ritmul oprezhaet ruperea acestuia. Teoria reacțiilor în lanț a fost dezvoltat lucrări de academicianului NN Semenov, SN Hinshelwood (Anglia), și altele. Oamenii de știință.
Există o reacție în lanț, în care rolul particulelor active nu ies radicalii liberi și ionii care rezultă din heterolitice rupe o legătură chimică:
Un astfel de mecanism este adeseori în practică implementată în reacțiile de polimerizare ale compușilor organici nesaturați.