Clasificarea reacțiilor chimice în chimia organică și anorganică, EGE în chimie
Clasificarea reacțiilor chimice în chimia organică și anorganică
Reacțiile chimice sau fenomene chimice - este procese ca rezultat, care sunt formate unele dintre celelalte substanțe care diferă de acestea în structura și structura (sau).
Atunci când reacțiile chimice necesare o modificare a substanțelor în care se formează lacrimal obligațiuni vechi și noi între atomi.
Reacțiile chimice ar trebui să se facă distincție între reacțiile nucleare. Ca urmare a reacției chimice, numărul total de atomi din fiecare element chimic și compoziția sa izotopică nu se schimbă. O altă problemă de reacție nucleară - procese de transformare a nucleelor atomice ca rezultat al interacțiunilor lor cu alte nuclee sau particule elementare, de exemplu, magneziu conversie aluminiu la:
Clasificarea multidimensională a reacțiilor chimice, adică Diferite caracteristici pot fi puse în baza sa. Cu toate acestea, în conformitate cu oricare dintre aceste caracteristici pot fi clasificate ca reacția dintre materialele anorganice și organice între.
Luați în considerare clasificarea reacțiilor chimice pe diferite motive.
Clasificarea reacțiilor chimice privind numărul și componența reactanți. Reacțiile merge fără a schimba compoziția substanței
În chimia anorganică pentru astfel de reacții includ preparatul procesează modificări alotropice ale elementului chimic, de exemplu:
În chimia organică pentru acest tip de reacție se poate face referire izomerizării, reacțiile care merg fără a schimba nu numai calitativ, ci și compoziția cantitativă a substanțelor moleculare, de exemplu:
1. Izomerizarea alcani.
Izomerizarea alcani este de mare importanță practică, deoarece hidrocarburi cu catenă ramificată au o capacitate mai mică la detonare.
2. izomerizarea alchene.
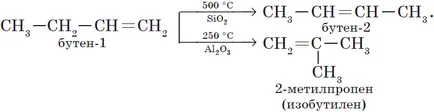
3. Izomerizarea alchine (A. E. Favorskogo reacție).
4. Izomerizarea haloalcani (A. E. Favorsky).
5. Izomerizare cianat de amoniu sub încălzire.
Mai întâi ureea a fost sintetizată de F. Wohler în cianatul de amoniu 1882 izomerizare când este încălzit.
Reacțiile care au loc cu o schimbare în compoziția materiei
Patru tipuri de aceste reacții pot fi distinse: descompunerea compusului, substituția și schimbul.
1. Reacțiile compusului - sunt acele reacții în care două sau mai multe substanțe formate o singură substanță complexă.
În reacțiile chimice anorganice toți compușii manifold pot considera ca exemplu reacțiile care produc acid sulfuric de sulf:
1) asigurarea unui oxid de sulf (IV):
$ S + O_2 = SO_2 $ - două substanțe simple, formate de un complex;
2) obținerea unui oxid de sulf (VI):
$ 2SO_2 + O_2↖2SO_3 $ - de compuși simpli și complecși formați de un singur complex;
3) care produc acid sulfuric:
$ SO_3 + H_2O = H_2SO_4 $ - din cele două materiale compozite formate unul complex.
Un exemplu al reacției compusului la care este format dintr-un compus complex de mai mult de două surse pot servi ca etapă finală de obținere a acidului azotic:
În chimia organică, compusul de reacție este de obicei numită reacție de adiție. Toate varietate de astfel de reacții pot fi luate în considerare pe un exemplu al blocului reacțiilor proprietăți ale compușilor nesaturați, cum ar fi etilena caracterizează:
1) Reacția de hidrogenare - adăugarea de hidrogen:
2) reacția de hidratare - adăugarea de apă:
3) o reacție de polimerizare:
2. Reacțiile de descompunere - aceste reacții, în care o substanță complexă a format mai multe substanțe noi.
În chimia anorganică întreagă varietate de astfel de reacții pot fi luate în considerare, de exemplu, blochează producerea de reacții de oxigen metode de laborator:
1) descompunerea oxidului de mercur (II):
$ 2HgO↖2Hg + O_2 ↑ $ - unul dintre un compus format din două simplu;
2) descompunerea azotatului de potasiu:
$ 2KNO_3↖2KNO_2 + O_2 ↑ $ - unul dintr-un compus format un simplu și un complex;
3) descompunerea permanganat de potasiu:
$ 2KMnO_4↖K_2MnO_4 + MnO_2 + O_2 ↑ $ - o singură substanță complex format din două unul complex și simplu, adică, trei substanțe noi.
În chimia organică, reacția de descompunere poate fi considerat, de exemplu, etilena bloc obținerea reacțiilor în laborator și industrie:
1) reacția de deshidratare (eliminarea apei) de etanol:
2) reacția de dehidrogenare (captarea hidrogenului) etan:
3) cracare reacție (scindare) propan:
3. Reacțiile de substituție - aceste reacții, ca urmare a care un simplu atomi de substanță substituită atomii de orice element dintr-un mediu complex.
In chimie anorganica, exemple de astfel de procedee pot servi reacții bloca proprietăți caracteristice, de exemplu, metale:
1) reacția dintre metalele alcaline și alcalino-pământoase cu apă:
2) reacția metalului cu un acid în soluție:
3) reacția cu săruri metalice în soluție:
Subiectul studiului chimiei organice nu este o chestiune simplă, și singura conexiune. Prin urmare, ca un exemplu al reacțiilor de substituție prezintă proprietatea cea mai caracteristică de limitare a compușilor, în special metan; - capacitatea atomilor săi de hidrogen înlocuiți cu atomi de halogen:
Un alt exemplu - bromurarea compușilor aromatici (benzen, toluen, anilină):
Notă reacțiile de substituție caracteristică în substanțe organice, ca urmare a unor astfel de reacții produc un complex și nu este o chestiune simplă ca în chimie anorganică, și două substanțe complexe.
În chimia organică pentru substituție reacții includ o reacție între două materiale complexe, de exemplu, nitrarea benzen:
Este în mod oficial reacția de schimb. Faptul că această reacție de substituție, devine clar doar atunci când se analizează mecanismul.
4. Reacțiile de schimb - aceste reacții, în care doi agenți esteri ai face schimb de părți componente ale acestora.
Aceste reacții sunt caracterizate prin proprietățile electroliți în soluții curg prin regula Berthollet, adică Numai dacă se formează un precipitat ca substanță rezultat, gaz sau malodissotsiiruyuschee (de exemplu, $ $ N_2O).
In chimie anorganica, acesta poate fi un bloc de reacții care caracterizează, de exemplu, proprietăți alcaline:
1) neutralizând reacția merge la forma de sare și apă:
sau sub formă ionică:
2) reacția dintre alcalii și sare, care merge pentru a forma gazul:
sau sub formă ionică:
3) Reacția dintre sarea alcalină și mersul pentru a forma un precipitat:
sau sub formă ionică:
În reacțiile chimice organice pot lua în considerare bloc caracteristică, de exemplu, proprietăți de acid acetic:
1) reacție, care merge pentru a forma un electrolit slab - $ H_2O $:
2) de gaz de reacție vor forma:
3) reacția vor forma un precipitat:
Clasificarea reacțiilor chimice pentru a schimba elementele chimice starea de oxidare care formează substanțe
Reacțiile care au loc cu stările elementelor de schimbare de oxidare, sau reacții redox.
Acestea includ o varietate de reacții, inclusiv toate reacțiile de substituție și aceste reacții și descompunerea compusului, care a implicat cel puțin o substanță simplă, cum ar fi:
După cum vă amintiți, reacțiile redox complexe sunt preparate prin metoda echilibrului de electroni:
În chimia organică exemplu izbitoare reacții redox de aldehide pot servi proprietăți:
Aldehide 1 sunt restaurate la alcoolii corespunzători:
2. Aldehidele sunt oxidați la acizii corespunzători:
Reacțiile de mers fără a modifica gradul de oxidare a elementelor chimice.
Acestea includ, de exemplu, includ toate reacția de schimb de ioni, precum:
- Multe reacție de cuplare:
- Multe din reacția de descompunere:
Clasificarea reacțiilor chimice pe efectul termic
Prin căldura de reacție împărțită la exotermă și endotermă.
Aceste reacții continua cu eliberarea de energie.
Acestea includ aproape toate reacția de cuplare. Excepția rare de reacții endoterme ale sintezei de oxid nitric (II) de azot și oxigen și reacția de hidrogen gazos cu iod solid:
$ N_2 + O_2 = 2NO - Q $,
reacții exoterme care au loc cu eliberarea de lumină, numite reacții de combustie, de exemplu:
Hidrogenarea etilenă - Exemplu de reacție exotermă:
Este la temperatura camerei.
reacție endotermă
Aceste reacții apar cu absorbție a energiei.
Este evident că acestea includ aproape toate reacției de descompunere, cum ar fi:
a) calcar prăjire:
b) cracare butan:
Număr izolat sau absorbit ca rezultat al energiei de reacție se numește căldura de reacție. o ecuație de reacție chimică care indică acest efect se numește ecuația termochimic. de exemplu:
Clasificarea reacțiilor chimice în starea de agregare a reactanților (compoziția fazei)
Această reacție în care reactanții și produșii de reacție sunt în diferite stări de agregare (în faze diferite):
Această reacție în care reactanții și produșii de reacție sunt într-o stare de agregare (într-o singură fază):
Clasificarea reacțiilor chimice pe participarea catalizatorului
Reacțiile necatalitic continua fără participarea catalizator:
Reacțiile catalitice au loc cu catalizatorul:
Deoarece toate reacțiile biologice care au loc în celulele organismelor vii, sunt catalizatori biologici oferind speciale ale naturii proteinelor - enzime, toate acestea aparțin catalitice sau, mai precis, o enzimatică.
Trebuie remarcat faptul că mai mult de $ $ 70% producții chimice care utilizează catalizatori.
Clasificarea reacțiilor chimice în direcția
Reacțiile ireversibile continua în aceste condiții numai direcția AP.
Acestea includ toate reacția de schimb, însoțită de formarea de nămol, gaze sau substanțe malodissotsiiruyuschego (apă) și toate reacția de ardere.
Reacțiile reversibile în aceste condiții apar simultan în două direcții opuse.
Astfel de reacții sunt majoritatea covârșitoare.
În chimia organică, un semn de reversibilitate reflecta procese-name antonime:
- gedrirovanie - dehidrogenare;
- Hidratarea - deshidratare;
- polimerizare - depolymerization.
Toate reacția reversibilă de esterificare (procesul invers, după cum știți, se numește hidroliză) și hidroliza proteinelor, esteri, hidrați de carbon, polinucleotide. Reversibilitatea stă la baza procesului de cel mai important în organismul viu - metabolismul.