Cine a inventat bateria - atunci când a inventat
Strict vorbind, denumirea comună „bateria“ nu este destul de corect. Acesta combină mai multe tipuri de surse de alimentare pentru dispozitivul de alimentare autonomă. Acest lucru poate fi o singură celulă electrochimică, bateria sau conectarea mai multor astfel de elemente la baterie pentru a crește detensionare. Este această conexiune și a dat naștere la numele familiar pentru urechea noastră.
Baterii și celule electrochimice și baterii sunt surse chimice de curent electric. Prima astfel de sursă a fost inventat așa cum se întâmplă atât de des în știință medic accidental italian și fiziolog Luigi Galvani de la sfârșitul secolului al XVIII-lea.
Cu toate că energia electrică este un fenomen familiar omenirii din cele mai vechi timpuri, de multe secole, aceste observații nu au nici o aplicație practică. Numai în 1600, fizicianul englez William Gilbert a publicat un tratat „Pe magnetul, corpurile magnetice și marele magnet Pământ“, unde au fost rezumate cunoscute la datele de timp cu privire la electricitate și magnetism, iar în 1650 Otto Fon Gerike creat electrostatic Masina este balon sulfuric este montat pe bara metalică. Un secol mai târziu, olandezul Pieter van Musschenbroek prima dată a reușit să salveze cu „borcan Leyden“ din primul condensator o cantitate mică de energie electrică. Cu toate acestea, a fost prea mic pentru experimente serioase. Studii savanți "naturale" de energie electrică implicat, cum ar fi Benjamin Franklin, George Richman, Dzhon Uolsh. A fost ultima lucrare de stingrays interesat Galvani.
Scopul real al experimentului bine-cunoscut de Galvani, o revoluție în fiziologie și pentru totdeauna înscris numele său în știință, acum nimeni nu va aminti. Galvani disecat o broască și a pus-o pe masă, în cazul în care a existat o mașină electrostatică. Asistentul său a atins accidental vârful unui bisturiu pentru a deschide nervul femural de broasca și mușchiul mort este redusă brusc. Un alt consilier a spus că acest lucru se întâmplă doar atunci când autovehiculul este preluat scânteie.
Inspirat de descoperirea lui Galvani a început să exploreze metodic fenomenul observat este capacitatea unui medicament mort demonstrează contracția vitală sub influența electricității. Dupa ce a petrecut o întreagă serie de experimente, Galvani a fost un rezultat deosebit de interesant, folosiți cârlige de cupru și farfurie de argint. În cazul în care cârligul care deține piciorul, atingând placa, piciorul, atingând placa, imediat a scăzut și a crescut. După ce a pierdut contactul cu placa, mușchii picioarelor imediat relaxat, ea a căzut din nou pe recordul, a scăzut și a crescut din nou.

Luigi Galvani. ilustrare Magazine. Franța. 1880
Deci, după o serie de experimente meticuloase, și o nouă sursă de energie electrică a fost deschisă. Galvani însuși, cu toate acestea, nu se gândească la ceea ce el a descoperit cauza de metale diferite de contact fenomene. Potrivit lui, sursa de curent a fost un foarte mușchi care a fost entuziasmat de acțiunea creierului, transmise prin intermediul nervilor. Deschiderea Galvani a provocat o senzație și a dus la o mulțime de experimentare în diferite ramuri ale științei. Printre adepții fiziologul italian a dovedit fizicianul său compatriotul Alessandro Volta.
In anul 1800, Volta nu și-a dat doar explicația corectă a fenomenului deschis Galvani, dar, de asemenea, proiectat un dispozitiv care a devenit prima sursă chimice artificiale din lume de curent electric, strămoșul tuturor bateriilor moderne. Acesta a constat din doi electrozi anodului conținând un oxidant și un catod cuprinzând reducătorul în contact cu electrolitul (saramura, acizi sau alcali). Diferența de potențial care a avut loc între electrozi în acest caz corespunde energiei libere reacției redox (electroliza), în care sunt reduse cationii de electrolit (ioni încărcați pozitiv) și anioni (ioni încărcați negativ) sunt oxidate pe electrozii respectivi. Reacția poate începe numai când electrozii sunt conectate la un circuit extern (Volta alăturat sârmă obișnuită), pe care electronii liberi se deplasează de la catod la anod, creând astfel un curent de descărcare. Deși bateriile moderne au puține în comun cu volti dispozitivului, principiul de funcționare rămâne neschimbat: cei doi electrozi cufundați într-o soluție de electrolit și conectat la un circuit extern.
Invenția se Volta a dat un impuls semnificativ de cercetare legate de energie electrică. În același an, oamenii de știință și Uilyam Nikolson Entoni Karlayl descompus de apă electroliză în hidrogen și oxigen, un pic mai târziu Hemfri Devi același mod deschis de metal de potasiu.
Experimentele Galvani cu o broască. Gravură 1793
Dar, în primul rând celulele galvanice este cu siguranță cea mai importantă sursă de curent electric. De la mijlocul secolului al XIX-lea. când primele aparate electrice, a început producția de masă a bateriilor chimice.
Toate aceste elemente pot fi împărțite în două tipuri principale: primare, în care o reacție chimică este ireversibilă și secundar, care poate fi reîncărcată.
Ceea ce am folosit pentru a apela bateria este primar surse de energie chimice, cu alte cuvinte, elementul de bază non-reîncărcabile. Primele baterii care rulează în producția de masă, a fost invenția în 1865 de francezul Georges Leklanshe baterii zinc-mangan cu o soluție salină și apoi cu electrolit suspendat. Până la începutul anilor 1940, a fost practic singurul de tipul celor utilizate în celule electrochimice, care datorită costului redus al scară largă până în prezent. Astfel de baterii sunt numite elemente uscate sau carbon-zinc.

Gigant baterie electrică, construit de William Wollaston pentru experimente X. Davey.
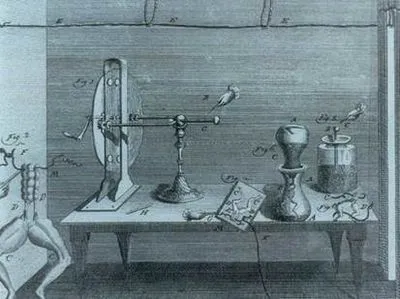
Schema de artificiale chimice curent sursa A. Volta.
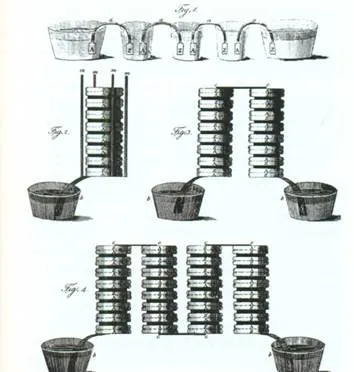
În 1803 Vasily Petrov a creat cel mai puternic gramada voltaice din lume, folosind 4200 de cercuri de metal. El a fost capabil să dezvolte o tensiune de 2500 V, precum și pentru a deschide un astfel de fenomen important ca un arc electric, care mai târziu a ajuns să fie utilizat la sudarea electrică, precum și pentru siguranțe fuzibile electrice explozivi.
Dar un adevărat progres tehnologic a fost apariția de baterii alcaline. Deși compoziția chimică nu sunt în mod particular diferite de elemente Leklanshe și tensiunea lor nominală se compară cu celula uscată este crescut ușor, datorită unei schimbări fundamentale în modele alcaline poate servi de patru până la cinci ori mai uscat, cu toate acestea, în anumite condiții.
Cea mai importantă sarcină în dezvoltarea de baterii este de a crește capacitatea unei celule reducând în același timp mărimea și greutatea sa. Pentru a face acest lucru, mereu în căutarea de noi sisteme chimice. Elementele cele mai high-tech primare de astăzi sunt de litiu. Capacitatea lor este de două ori capacitatea celulelor uscate, și durata de viață semnificativ mai mare. Mai mult decât atât, în cazul în care bateriile alcaline sunt uscate și evacuate treptat, tensiunea exploatație de litiu în timpul practic întreaga viață de serviciu, și numai apoi pierde rapid. Dar chiar și cele mai bune bateria nu poate fi comparat în eficiența cu o baterie reîncărcabilă, principiul de funcționare se bazează pe o reacție chimică reversibilă.
Cu privire la posibilitatea unui astfel de dispozitiv a început să se gândească în secolul al XIX-lea. In 1859 francezul Gaston Plante a inventat bateria plumb-acid. Curentul electric în ea apare ca rezultat al reacțiilor de plumb și dioxid de plumb în mediu de acid sulfuric. În timpul generării bateriei descărcate curent consumă acid sulfuric pentru a forma sulfatul de plumb și apă. Pentru a încărca curentul necesar derivat dintr-o altă sursă, pentru a trece prin circuit în direcția opusă, apa care urmează să fie utilizat pentru formarea acidului sulfuric pentru a elibera plumb și plumb dioxid de carbon.
Deși principiul de funcționare a unui astfel de baterie a fost descrisă pentru o lungă perioadă de timp, producția de masă a început abia în secolul XX. ca dispozitiv pentru reîncărcare necesită înaltă tensiune, precum și respectarea unui număr de alte condiții. Odată cu dezvoltarea de baterii electrice plumb-acid au devenit indispensabile și sunt încă folosite astăzi în automobile, troleibuze, tramvaie și alte mijloace de transport electrice, precum și pentru alimentarea cu energie de urgență.
O mulțime de aparate electrice de uz casnic de mici sunt, de asemenea, lucrează la un „baterii de unică folosință“ baterii reîncărcabile care au aceeași formă ca și celula non-regenerativă. Dezvoltarea de electronice depinde de evoluțiile din acest domeniu.

Bateria J. Leklanshe.

baterie uscată.
În primul rând pentru a înlocui celulele galvanice vin baterii nichel-cadmiu și nichel-metal hidrură. neajuns major al acestora a fost „efect de memorie“, scăderea capacității, atunci când încărcarea se realizează când bateria nu este complet descărcată. Mai mult decât atât, ei pierd treptat taxa, chiar și în absența sarcinii. Aceste probleme au fost în mare parte rezolvate în dezvoltarea bateriilor litiu-ion și litiu-polimer, care acum sunt utilizate pe scară largă în dispozitive mobile. Capacitatea lor este mult mai mare, au acuzat Lossless, în orice moment și să păstreze taxa de bun în așteptare.


Dispozitiv modern pentru încărcarea celulelor AA reîncărcabile.