Chimie coloid Subiect
Numele chimiei coloidale provine din limba greacă - lipici.
Primul obiect al studiului au fost lipite ca și substanțele chimice coloid - gelatină, pectină, cazeină și alți compuși macromoleculari.
chimiei moderne coloidale a extins în mod semnificativ granițele sale și în secțiunea de chimie fizică a apărut ca o știință independentă. Și trebuie să spun, moderne chimia coloidală - una dintre puținele științe, al cărui nume nu se potrivește cu conținutul. Acesta a primit acest nume înainte a fost format ca o știință independentă. În unele țări, este redenumit „fenomene de suprafață“, „fenomene de suprafață și sisteme disperse“.
Obiectele de studiu al chimiei coloidale moderne sunt sisteme disperse și compuși macromoleculari. O atenție deosebită este acordată în fenomenele de suprafață chimie coloidale - procesele care au loc la interfața.
În cursul chimiei fizice ne-am uitat la sistemul în care interfața nu a jucat un rol semnificativ. La suprafață au simțit fenomene, ar trebui să fie dezvoltate interfața, care se realizează prin zdrobirea una dintre faze.
Suprafața interfază sunt foarte dezvoltate sisteme dispersate.
Capitolul sistem I.Dispersnye:
CARACTERISTICI CHEIE ȘI CLASIFICARE
1.1 Proprietățile de bază ale sistemelor disperse
Eterogenitatea. Orice sistem de dispersie este format din două sau mai multe faze, și anume eterogen (Fig. 2).
Fragmentată (discontinua) parte a fazei disperse a sistemului 1. nazyvayutdispersnoy și nemăcinată (continuă) - dispersia (solid) mediul 2.
Între faza dispersată și mediul de dispersie este format interfață. O condiție necesară pentru formarea sistemului disperse este solubilitate insolubilă sau limitată a fazei dispersate și mediul de dispersie.
Coloidală dispersiile studiu chimiei în care particulele de fază dispersată, au o dimensiune de 10-9- 10-7 M (1-100 nm). Aceste sisteme coloidale.
Dispersii cu aceleași dimensiuni particule numite monodisperse. cu particule diferite dimensiuni - polidispersa. Sistemele reale sunt, în general polidispersa.
suprafață specifică mare. O caracteristică cantitativă a interfeței sistemelor disperse este poverhnostSud specific - S. zona interfacială pe unitatea de masă sau de volum V m a fazei dispersate:
Dacă particulele de fază disperse au o formă de cub cu lungimea laterală a și aceeași dimensiune, atunci
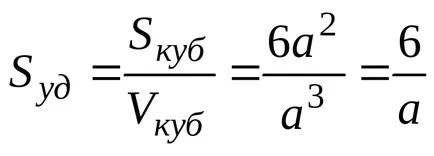
Pentru particule sferice cu rază r
SSF = 4r 2. VSF = 4 / 3r 3.
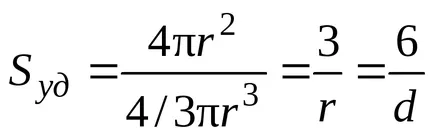
În general, pentru sistemele care conțin particule freeform
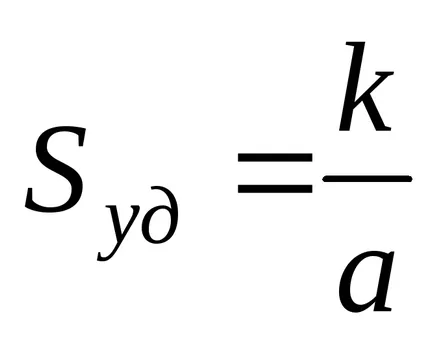
unde k - factor în funcție de forma particulelor; și - dimensiunea particulelor liniare selectate (dimensiunea caracteristică).
Reciproca dimensiunea caracteristică, numită dispersnostyuD:
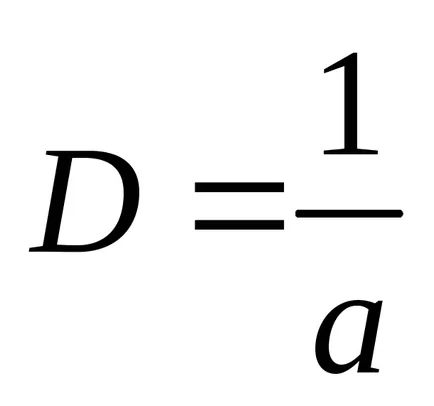
Din aceste raporturi este evident că mai mică caracteristica dimensiunii particulelor de fază dispersată, cea mai mare suprafață specifică și dispersabilitatea. Arătăm acest lucru printr-un exemplu.
Să considerăm o particulă de formă cubică.
Astfel, la sfărâmarea particulelor crește dramatic suprafața specifică a fazei dispersate.
Cea mai mare energie de suprafață necompensate. Diferența dintre compoziția fazelor adiacente și natura interacțiunilor intermoleculare în aceste faze cauzează ocurență energiei de suprafață necompensate. Deoarece fragmentare și de suprafață ridicată dispersii de interfață sunt caracterizate prin energie semnificativă de suprafață în exces.
Să considerăm sistemul de gaz-lichid.
Pentru particule în faza lichidă în vrac, forța rezultantă a interacțiunii intermoleculare este 0, deoarece împrejurimile din toate direcțiile în mod egal. Forța de vectori îndreptat în direcții diferite, dar sunt egale în mărime. Se pare câmp de forță simetrică.
Particulele dispuse pe suprafața interacționează atât cu particule omogene și cu părți-
Tsami un alt fel. Firește, că atracția prin atragerea moleculelor de gaz este mai slabă de moleculele de lichid. Ca rezultat, asimetria câmpului de forță o forță rezultantă îndreptată spre interior faze mai dense (lichid). Acest efect este adesea menționată la presiunea internă. Cu cât mai puternică interacțiunile intermoleculare în diferite faze adiacente, cu atât mai mare presiunea internă. Pentru lichide la interfața cu presiunea internă a aerului este foarte mare, de exemplu, este de 14.800 atmosfere de apă. De aceea, picătura de lichid cu creșterea presiunii externe nu modifică greutatea sa specifică, adică, acestea sunt incompresibile.
Pentru toate particulele din capacitatea nerealizată strat de suprafață pentru interacțiunea cu laturile una dintre faze (în acest caz, gazul) caracterizează Gpov energie liberă de suprafață. și care determină cursul diferitelor procese de suprafață.
Evident, cantitatea totală de energie a fazei de suprafață este determinată de mărimea suprafeței sale S. Prin urmare, caracteristicile interfeței separarea acestei faze de cealaltă, a introdus conceptul de tensiune superficială.
Tensiunea superficială - această cantitate fizico-chimică ce caracterizează funcționarea unității de proces termodinamic reversibil de suprafață nou, la temperatura, presiunea și compoziția fluidului constant.
Pentru a forma suprafața interfacială, este necesar să se transfere o parte din moleculele volumului de lichid la suprafață. Pentru aceasta este necesar să se efectueze de lucru împotriva presiunii interne care tinde să atragă fază molecule de suprafață în interiorul stratului.
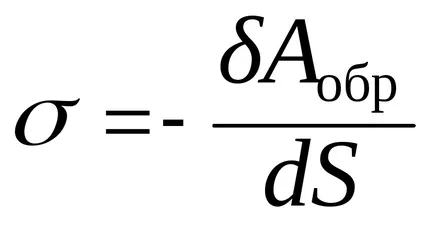
în cazul în care Aobr - lucru termodinamic reversibil; ca munca se face pe sistem, acesta este negativ.
în cazul în care G - energia liberă Gibbs,
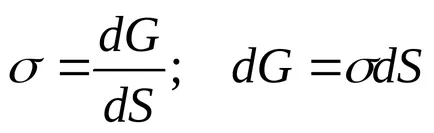
Astfel, tensiunea superficială - este energia specifică suprafață liberă, adică, suprafață liberă de energie pe unitatea de suprafață interfacială.
Evident, este mai mică tensiunea de suprafață, cu atât mai ușor formarea unei noi suprafețe. De exemplu, formarea spumei, însoțită de creșterea suprafeței interfaciale este considerabil mai ușoare în soluție de detergent decât în apă pură cu tensiune superficială ridicată.
Unitatea de măsură a tensiunii superficiale - J / m 2 = N / m.
Tensiunea superficială caracterizează diferențele în intensitatea interacțiunilor intermoleculare ale fazelor adiacente. Cu cât diferențele, cu atât mai mult .
Tensiunea superficială permite suprafeței să reziste la greutatea de păianjen de apă, iar păianjenul să meargă pe suprafață. (Pentru a da un exemplu cu un ac).
Tensiunea superficială la interfața dintre cele două faze condensate numite interfaza. Acesta este format la interfața a două lichide reciproc insolubile, solid-lichid și două corpuri solide și, respectiv, notat-zh w. t-Ei bine. t-t.
Tensiunea superficială scade odată cu creșterea temperaturii. Acest lucru se datorează creșterii presiunii vaporilor și a reduce interacțiunile intermoleculare necompensate. Prin urmare, este necesar să se indice temperatura în valorile de evaluare .
La 293 K tensiunea superficială a apei este de 72,75 mJ / m ulei de floarea soarelui 2. - 33, lapte crud - 45-60 și vinurile seci - 46-52 mJ / m 2 de mai jos apă.
Conform principiului energiei libere minime, orice fază va încerca să reducă energia de suprafață. Prin urmare, sistemul fluid ia forma unei suprafețe minime pentru o anumită fază de volum - o sferă.
Efectul de curbură a suprafeței. H curbură determinată de derivata ariei suprafeței în volum:
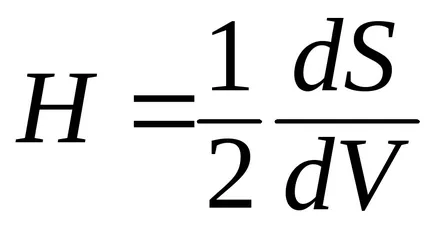
Curbura poate fi pozitiv sau negativ. În cazul în care centrul cercului se află în interiorul corpului, care este determinată de curbura suprafeței, este pozitiv; în cazul în care centrul cercului din corp, curbura este negativ. Curbura suprafeței plate este egală cu zero, iar raza de curbură - infinit. Odată cu creșterea razei de curbură a descrește curbură.
Curbura suprafeței afectează un număr de proprietăți fizice și chimice. Astfel, presiunea de vapori saturați de deasupra suprafeței concave este mai mică decât cea de peste plan, adică, deasupra vaporilor de suprafață concavă condensează la o presiune mai mică.