bilet de examinare № 21
Principalele prevederi ale teoriei disocierii electrolitice. electroliți puternici și slabi. Constant și gradul de disociere. Legea de diluare.
Aplicarea practică a electrolizei. Galvanizare.
În prima jumătate a secolului al XIX-lea. Michael Faraday a introdus conceptul de electroliți și non-electroliti. El a numit electroliții substanțe ale căror soluții apoase conduce curentul electric și non-electroliti - substanțe, soluții apoase care nu conduce curentul electric.
Pentru a explica proprietățile soluțiilor apoase de electroliți cercetator suedez S. Arrhenius (1859-1927) în 1887, el a propus teoria disocierii electrolitice.
Conform acestei teorii, atunci când este dizolvat în apă, electroliți se descompun în ioni liberi. Acest proces se numește disociere electrolitica. Apoi, soluțiile de substanțe sunt conductori de curent electric atunci când conțin ioni (particule încărcate pozitiv sau negativ) care in domeniul electric vin în mișcare direcționată.
Dar această teorie nu răspunde la câteva întrebări: de ce unele substanțe sunt electroliți, iar altele nu? Care este rolul jucat de solvent în formarea de ioni?
Percepțiile de disociere a electroliților au fost dezvoltate de chimiști români I. A. Kablukova și V. A. Kistyakovskogo. Ei au aplicat la explicarea procesului teoriei disocierii electrolitice a soluțiilor chimice D. I. Mendeleeva. După cum se știe, este demonstrat experimental că există o interacțiune chimică între solut prin dizolvarea electroliți cu apă, ceea ce conduce la formarea de hidrați și apoi se disociază în ioni. Acești ioni sunt asociate cu molecule de apă, adică sunt hidratați. ionii hidratați în soluție sunt în mișcare aleatoare constantă. Dacă această soluție este plasat electrozii încărcați opus, ionii pozitivi se vor deplasa spre catod - acestea sunt numite cationi și negativ se va muta spre anod - și de aceea ele sunt numite anioni.
Pentru a pătrunde esența procesului de disociere electrolitica a ajutat la stabilirea natura legăturii chimice.
Electrolitii poate fi doar o substanță cu legături covalente ionice și polare. Știi că aceste substanțe - este de sare, baze, acizi. Amintiți-vă definirea claselor acestor substanțe din punct de vedere al teoriei disocierii electrolitice.
S. Arrhenius pentru caracterizarea cantitativă a disociere electrolitica a introdus conceptul de gradul de disociere electrolitica, notată cu litera grec.
Gradul de disociere electrolitica - este raportul dintre moleculele de electrolit dezintegrată în ioni, numărul total de molecule de solut.
Dacă a = 0, substanța nu se disociază în ioni, nu este un electrolit. Aceasta nu include substanța electroliții cu polaritate scăzută, și legături covalente nepolare, cum ar fi eteri, hidrocarburi, oxigen, azot și altele.
Gradul de disociere electrolitica poate avea o valoare de la 0 la 1 (în procente la 0 la 100%).
electroliți puternici - sunt acei electroliți care în soluții apoase (chiar concentrate) aproape disociază complet în ioni. O astfel de grad de disociere a electrolitului tinde la 1 (100%). Prin electroliți puternici includ aproape toate săruri, acizi anorganici (HNO3, HK1, HBr, HI, NClO4, NMp04, H2SO4), alcaline (lion, NaOH, KOH, RON, SSON, Ca (OH) 2, Sr (OH) 2, ba (OH) 2, Ra (OH) 2).
Electroliții slabi - acestea sunt electroliți care nu disociază complet în ioni în soluții apoase. Gradul lor de disociere este mult mai mică de 1 (100%), în majoritatea cazurilor, acesta tinde la zero. Dar când este diluat, după cum vă amintiți, crește gradul de disociere.
electroliții slabi includ multe acid anorganic (H 2 S, HF, H2CO3, N2SiO3, NNO2, N2SO3), acizi organici, baze (cu excepția alcaline), hidrat, amoniac NH3 • H20, H2O, apa cu sare.
În soluțiile de electroliți slabe datorită disocierii lor incomplete se stabilește un echilibru dinamic între moleculele nedisociate și ionii. De exemplu, acidul acetic: CH3COOH.
Constanta de echilibru care caracterizează procesul electrolitic de disociere slabă, denumită constanta de disociere. Constanta de disociere descrie capacitatea electrolitului (acid, bază, apă) pentru a se disocieze în ioni. Cu cât este mai constanta de disociere, cu atât mai ușor electrolitul se desparte în ioni, în consecință, cu atât mai puternic este. Constantele de disociere ale electroliți slabe sunt date în referințele bibliografice.
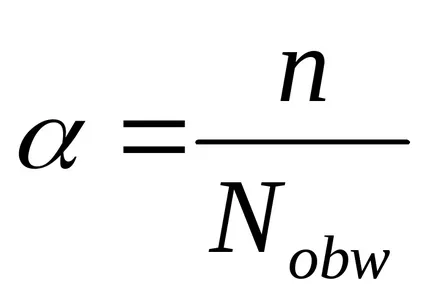
medie 3 < <30 %
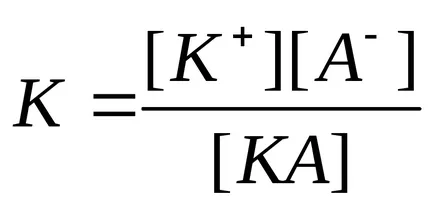
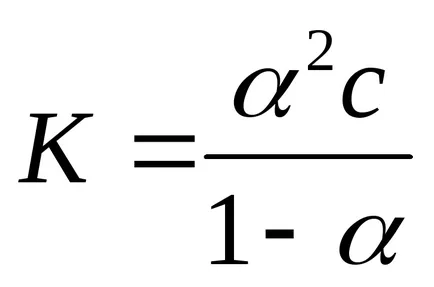
- dreptul de diluare
Utilizat în industrie:
1. Pentru metale (aluminiu, magneziu, sodiu, cadmiu obținut numai prin electroliza).
2. Pentru un hidrogen, halogen, alcalii.
3. Pentru a curăța metale - rafinare (curățare cupru, nichel, plumb este realizată prin metoda electrochimică).
4. Pentru a proteja împotriva coroziunii metalelor - strat protector ca un strat subțire de alt metal, rezistent
Vågå coroziune (crom, nichel, cupru, argint, aur) -
electrolitica (fig. 46).
5. Prepararea copii metalice ale înregistrărilor - galvanoplastie.
Galvanoplastie (de la galvano. & Technology), domeniul electrochimiei aplicate, acoperind procesele de depunere electrolitică a metalelor pe suprafața metalului și produsele metaloid. Acesta include și electroformarea electrolitica. B. S. Yakobi dezvoltată (1838).
Galvanica (din greacă și galvanică STEGO - .. Pature), placare metalică pe suprafața metalului și a altor articole prin electrodepunere. Secțiunea galvanica.
Electroforming (de la plastike greacă și galvanică - .. Sculpting) copii exacte de metal prin depunerea electrolitică a metalului pe metal sau original, non-metalic. Secțiunea galvanica.