Așa cum se produce sinteza proteinelor
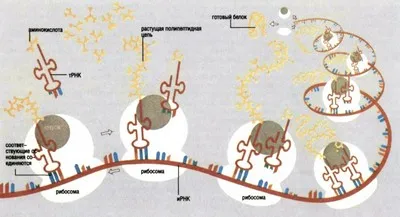
Fiecare domeniu al științei are propria „pasăre albastră“; Cibernetică vis de „gândire“ mașini, fizica - pe reacțiile termonucleare controlate, chimiști - sinteza „materiei vii“ - proteine. Sinteza proteinelor de mai mulți ani, subiectul romanelor science fiction, un simbol al puterii viitoare de chimie. Acest lucru explică rolul enorm care face parte din proteina din lumea celor vii, și dificultățile care au apărut în mod inevitabil, înainte de fiecare temerar care a îndrăznit „să se plieze“ a aminoacizilor individuali ai mozaicul complicate de proteine. Și nici măcar cele mai multe proteine și peptida numai.
Diferența dintre proteine și peptide nu numai terminologia, deși lanțurile moleculare ale ambelor grupe formate din resturi de aminoacizi. La un moment dat, numărul de treceri în calitate: lanț peptidic - structura primară - dobândește capacitatea de a se pliază într-o spirală și spirele care formează structurile secundare și terțiare caracteristice chiar și pentru materia vie. Și apoi devine o proteină peptidă. limită clară nu există aici - nu poate fi pus pe marcajul de delimitare a lanțului de polimer: până în prezent - peptida de aici - proteine. Dar este cunoscut, de exemplu, că hormonul adranokortikotropny constând din resturi de acid 39 aminoacizi - este un hormon polipeptidic și insulină, care constă din 51 de reziduuri în forma a două lanțuri - este proteina. Cel mai simplu, dar încă alb.
Metoda de aminoacizi din compusul peptidic a fost deschis la începutul secolului trecut de către chimistul german Emilem Fisherom. Dar pentru o lungă perioadă de timp după care chimiști nu au putut contempla serios nu numai sinteza de proteine sau peptide 39-mer, dar chiar și lanțurile semnificativ mai scurte.
Procesul de sinteza proteinelor
Pentru a interconecta doi aminoacizi, este necesară pentru a depăși multe dificultăți. Fiecare amino acid, cum ar Janus două fețe are două entități chimice: grupă de acid carboxilic la un capăt și o grupare amină bazică - la alta. Dacă un aminoacid din carboxil ia grupă OH și o grupare amină pe cealaltă - un atom de hidrogen, atunci astfel formate două resturi de aminoacizi ale legăturii peptidice se pot conecta unele cu altele, și ca urmare există mai simplă a peptidelor - dipeptide. Și fulgi de moleculă de apă. Repetând această operație, este posibilă creșterea lungimii peptidei.
Cu toate acestea, acest lucru s-ar părea la prima vedere, o simplă operație este practic dificil să pună în aplicare: aminoacizii sunt foarte reticenți în a se conecta unele cu altele. Trebuie să-i activeze chimic, și „incalzeasca“, unul dintre capetele lanțului (de obicei, carboxil), și să efectueze reacția, respectând cu strictețe condițiile necesare. Dar asta nu e tot: A doua dificultate constă în faptul că a comunica între ele nu sunt rămășițele de aminoacizi diferiți, dar două molecule de același acid. În acest caz, structura peptidei sintetizate trebuie să fie diferit de dorit. Mai mult, fiecare aminoacid poate avea nu doi, ci un „Ahile«toe»puține - grupuri laterale reactive capabile de atașarea de resturi de aminoacizi.
Pentru a preveni prăbușirea reacției la calea specificată, este necesar să se camufleze țintă fals - „sigiliu“ pe durata reacției este realizată tot gruparea amino reactivă, cu excepția unuia, să li se alăture grupului de protecție în așa-numitul. Dacă acest lucru nu se face, atunci obiectivul va fi să crească, nu numai la ambele capete, dar, de asemenea, lateral, și aminoacizii nu va fi capabil să se conecteze într-o secvență predeterminată. Și, de fapt, acesta este înțelesul tuturor sintezei dirijate.
Dar a scăpa, astfel, de la un chimisti probleme cu care se confruntă cu o alta: grupările de protecție după sinteza pentru a elimina. În vremuri de Fischer au fost folosite ca o grupare de „apărare“, care este scindat prin hidroliză. Cu toate acestea, reacția de hidroliză este în mod tipic prea puternic „șoc“ la peptida care rezultă: abia construit „proiectare“ lui se destrăma de îndată ce a fost scos din „schele“ - grupuri protectoare. Numai în 1932, student la Fisher M. Bergmann a găsit o cale de ieșire din această situație: el a oferit pentru a proteja amino aminoacizii Carbobenzoxi, care pot fi îndepărtate fără a deteriora lanțul peptidic.
Sinteza aminoacizilor proteinei
În anii următori, el a propus un număr de așa-numitele metode de moale „împletit“ de aminoacizi cu unul de altul. Cu toate acestea, ei au fost, de fapt, doar o variație pe tema metodei Fischer. Variațiile în care a fost uneori dificil de a capta melodia originală. Dar principiul a rămas același. Și toate aceleași dificultăți au fost legate de protecția grupurilor vulnerabile. Pentru depășirea acestor dificultăți a trebuit să plătească număr tot mai mare de etape de reacție: un eveniment elementar - conectarea a doi aminoacizi - dezintegrat în patru etape. Și fiecare pas suplimentar - este pierderile inevitabile.
Chiar dacă se presupune că fiecare pas este un randament util de 80% (ceea ce reprezintă un randament bun), apoi prin cele patru etape de 80% din „topesc“, la 40%. Și aceasta este doar sinteza unei dipeptide! Dacă aminoacizii vor fi 8? Și dacă 51 este insulina? Adăugați la aceasta complexitatea asociată cu existența a două optice „în oglindă“ molecule formă de aminoacizi, dintre care în reacția necesită doar una, problemele de separare a Priplyusuet care rezultă din peptidele produse secundare, în special în cazurile în care acestea sunt la fel de solubile. Ce se întâmplă în sumă de: Drumul spre nicăieri?
Totuși, aceste dificultăți nu s-au oprit chimiști. Chasing „pasăre albastră“ a continuat. In 1954 a fost sintetizat polipeptide hormoni bioactive - vasopresina si oxitocina. Erau opt aminoacizi. In 1963 a fost sintetizat ACTH polipeptidic 39 membri - hormonul adrenocorticotrop. În cele din urmă, chimiști din SUA, Germania și China sintetizat prima proteină - insulina.
Ca acest lucru, cititorul va spune, la fel de greu, se pare, nu este condus nicăieri, și nu oriunde, ci pentru a realiza visul multor generații de chimiști! Este o piatră de hotar! Adevărat, este - un eveniment de cotitură. Dar să-l evalueze în mod rațional, renunțarea la senzaționalismul, semne de exclamare și emoțiile excesive.
Nu există nici o dispută: sinteza de insulina - un imens chimiști victorie. Acesta este un mare, munca titanica, demn de toată admirația. Dar, în același ego-ul, de fapt, și plafonul polipeptidelor chimie vechi. Este o victorie pe punctul de a înfrângerii.
Sinteza proteinelor și a insulinei
Insulina 51 aminoacizi. Pentru a le conecta în ordinea corectă, chimiști nevoie să-și petreacă 223 de răspunsuri. Atunci când, la trei ani după începerea primei de care a fost finalizată ultima dată, randamentul a fost mai putin de o sutime de procente. Trei ani, 223 etape, o sutime de procente - sunt de acord ca victoria este pur simbolică. Pentru a vorbi despre aplicarea practică a acestei metode este foarte dificil: prea mare asociat cu costurile sale de punere în aplicare. Dar, în cele din urmă nu este vorba despre sinteza relicve prețioase ale slavei chimiei organice și disponibilitatea medicamentelor esențiale, care este necesară mii de oameni din întreaga lume. Deci, metoda clasică pentru sinteza polipeptidelor epuizate la prima, cea mai simpla proteina. Prin urmare, „pasăre albastră“, din nou, a scăpat din mâinile chimiști?
Noua metodă de sinteză de proteine
Ideea de bază a noii metode este faptul că lanțul peptidic în creștere, care folosit pentru a fi lăsată la mișcarea aleatorie a soluției, este acum legat la un capăt la un suport solid - ca și în cazul în care au fost forțați să ancoreze în soluție. Murrayfield a luat rășină solidă și grupuri active sale „cravată“ pentru sfârșitul carbonil a primei colectate în peptida de aminoacizi. Reacțiile au fost în particulele de rășină. De „Labirintul“ moleculele sale au apărut mai întâi primele lăstarii viitoare de peptide. Apoi, într-un vas care intră de-al doilea aminoacid, moleculele sale sunt legate cu carbonil lor se termină cu capătul amino-terminal liber al „legat“ de aminoacizi, iar particulele au crescut un alt „etaj“ al viitorului „clădire“ a peptidei. Deci, pas cu pas, treptat construi întreaga peptidă-rășină.
Noua metodă are avantaje evidente: în primul rând, a fost rezolvată problema separării deșeurilor după aderarea fiecărui aminoacizi regulate - aceste produse sunt ușor spălate, iar peptida a ramas cusute la perlele de rasina. În același timp, evită problemele peptidelor în curs de formare a solubilității - unul dintre principalii dăunători ai metodei vechi; înainte ca acestea sunt adesea precipitate practic încetează să participe la procesul de creștere. Peptidele „elimina“ după sinteza cu un suport solid obținut aproape toate de aceeași mărime și structură, în orice caz, variația structurii a fost mai mică decât cu metoda clasică. Și de ieșire utilă corespunzătoare, mai mare. Cu această metodă de sinteză a peptidelor - o sinteză laborioasă, consumatoare de timp - ușor adaptabilă pentru automatizare.
Murrayfield a construit o mașină simplă, care este ea însăși un program dat execută toate operațiile necesare - alimentarea reactivilor, amestecarea, turnarea, spălarea, cu doză măsurată, adăugarea unei noi porțiuni și așa mai departe. În cazul în care vechea metoda de a se alătura unui aminoacid a trebuit să vireze 2-3 zile, Murrayfield de pe mașină împreună o zi de 5 aminoacizi. Diferența - de 15 ori.
Care sunt dificultățile de sinteza proteinelor
Metoda Murrayfield numita fază solidă sau heterogenă, a fost imediat adoptat de către chimiștii din întreaga lume. Cu toate acestea, după o perioadă scurtă de timp a devenit clar că o nouă metodă, împreună cu avantaje majore și are unele neajunsuri serioase.