Activitatea practică № 8 pp
1) Pentru a distinge substanțe: a) MgCl2; b) NaOH; a) Na2 CO3; g) NaNO3;
a) Acțiuni. Suntem adăugarea de acid clorhidric toate substanțele rr. Observații. Într-unul din tuburi este eliberat gaz. Ecuația de reacție:
Concluzii: carbonat de sodiu conținută în acest tub, ca Reacția continuă calitativă pentru ioni carbonat. b) acțiuni. Materialul rămas a fost dizolvat în apă și la această soluție a fost adăugat fenolftaleină. Observații. Într-unul din tuburi soluția devine roz. Ecuația de reacție:
Concluzii: O soluție de fenolftaleină devine roz într-un mediu alcalin (sub acțiunea ionilor OH -), astfel încât în acest tub este hidroxidul de sodiu. c) acțiuni. La soluția rămasă a fost adăugată o soluție de nitrat de argint (I). Observații. Într-unul din tuburi format un precipitat alb. Ecuația de reacție:
Concluzii: Acest răspuns calitativ ion clorură, de aceea, acest tub este clorură de magneziu. g) Acțiuni. La soluția rămasă a fost adăugat acid sulfuric concentrat și o bucată de cupru. Încălzită. Observații. gaz furnizat de culoare maro, cuprul se dizolvă și soluția devine albastră. Ecuația de reacție:
Concluzii: Reacția este nitrat calitativă ionic, prin urmare, acest tub este nitrat de sodiu.
2) Diferențe de substanțe: a) CaCO3; b) Ba (NO3) 2; a) Na2 SO4; d) Na2S
a) Acțiuni. Suntem adăugarea de acid clorhidric toate substanțele rr. Observații. Într-unul din tuburi este eliberată și gaz inodor, iar celălalt - cu un miros neplăcut. Ecuația de reacție:
Concluzie: In vitro, în care a stat gaz inodor conține
t. k. un răspuns de calitate la un ion carbonat. În cazul în care produc un miros neplăcut de gaz-effusing
conține sulfură de sodiu. b) acțiuni. După dizolvare, substanțele rămase în apă adăugarea unei soluții de sulfat de sodiu. Observații. Într-unul din tuburi format un precipitat alb. Ecuația de reacție:
Concluzii: reacție calitativă a ionilor de bariu, prin urmare, în eprubetă - azotat de bariu. c) acțiuni. Pentru restul de p-py rr adăugare de clorură de bariu. Observații. Precipitatul alb format. Ecuația de reacție:
Concluzii: Această reacție calitativă pentru ioni sulfat, prin urmare, în tub - sulfat de sodiu.
3) Să se arate că materialul emis - sulfat de aluminiu Al2 (SO4) 3
a) Acțiuni. Acesta a emis o soluție de clorură de bariu-adăugarea count. Observații. Precipitatul alb. Ecuația de reacție:
Concluzii: Acesta este răspunsul calitativ la ionul sulfat. b) acțiuni. Pentru o cantitate mică de soluție alcalină, o soluție de substanță eliberată. Observații. Un precipitat alb gelatinos. Ecuația de reacție:
Concluzii: Rezultatul este formarea unei baze insolubile
de ioni de legare
Prin urmare, în substanța de testat conține un ion de aluminiu. c) acțiuni. Adăugarea de exces alcalin. Observații. Excesul de precipitat alcalin dizolvat. Ecuația de reacție:
Concluzii hidroxid are proprietăți amfotere: sodiu format mataallyuminat. Acest lucru dovedește încă o dată că a emis substanța conține ioni de aluminiu.
4) pentru a distinge soluții: clorură de sodiu, BaCl2. AICI3
a) Acțiuni. Toată soluția a fost adăugată p-p de sulfat de sodiu. Observații. Într-unul din tuburile unui precipitat alb. Ecuația de reacție:
Concluzii: Acest tub conține clorură de bariu, după cum Această reacție - privind calitatea ionilor de bariu. b) acțiuni. Cele doua soluția rămasă a fost adăugată o soluție alcalină mică. Observații. Intr-unul din tuburile formează un precipitat alb gelatinos. Ecuația de reacție:
Concluzii: In acest tub de testare - de clorură de aluminiu. c) acțiuni. Câteva picături de soluție rămasă introduce în flacără la un fir nicrom lampă spirit. Observații. Flame devine galben. Concluzii: In acest tub de testare - clorură de sodiu, ca flacără galben pătat ioni de sodiu.
5) Să se arate că cristalele FeSO4 parțial oxidat și conțin impurități ioni de Fe 3+
Acțiuni. Cristalele se dizolvă în apă și adăugarea de p-p
Observații. Generat sedimente verde și maro. Ecuația de reacție:
Concluzii: sediment brun - bază insolubilă
Este verde. Prin urmare, Original
conținând oxizi de ioni
6) Două flacoane de date cu apă. Într-una dintre ele apa conține MgSO4. și în celălalt - Ca (HCO3) 2. Experimentele efectuate prin intermediul cărora rigiditate permanentă și temporară pot fi eliminate.
a) Acțiuni. Apa care conține
add rr
Observații. Se formează un precipitat alb. Ecuația de reacție:
Concluzie: Iona
provoca duritatea permanentă a apei. O astfel de apă poate fi dedurizată prin adăugarea unei soluții de carbonat de sodiu, t. K. Acest lucru are loc atunci când legarea ionului
b) acțiuni. Apa care conține
adaugă: O soluție de
lapte de var, și anume soluție saturată
se fierbe. Observații. Se formează un precipitat alb. Ecuația de reacție:
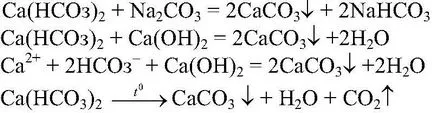
Concluzii: Prezența
Aceasta determină o duritate temporară a apei. Această apă poate fi dedurizată prin adăugarea de lapte de var sau sodă de fierbere, deoarece Toate aceste procese sunt însoțite de formarea
7) Efectuați conversia:
a) Fe → FeCl2 → Fe (OH) 2 → Fe (OH) 3 → Fe (NO3) 3
1. Acțiuni. Prin adăugarea de acid clorhidric de pulbere de fier. Ecuația de reacție:
2. Acțiuni. După ce degajarea gazului încetează, se adaugă o soluție alcalină. Ecuația de reacție:
3. Acțiuni. La reziduu se adaugă câteva peroxid de hidrogen r-ra. Ecuația de reacție:
4. Acțiuni. La reziduu s-a adăugat o soluție de ecuații de reacție de acid azotic:
b) Al → Al (SO4) 3 → Al (OH) 3 → NaAlO2
1. Acțiuni. Pentru mai multe pelete
add rr
Ecuația de reacție:
2. Acțiuni. După ce degajarea de gaz adăugarea alcaline (în picături). Ecuația de reacție:
3. Acțiuni. La reziduu s-a adăugat un exces de alcalii. Ecuația de reacție: