Activatori si inhibitori ai enzimelor
Activatori si inhibitori ai enzimelor
Reglementarea activității enzimelor pot fi enzime prin interacțiunea cu diferite componente biologice sau compuși străini, care sunt numite de reglementare a enzimelor. Ele pot accelera fie în sus sau încetini reacția enzimatică.
Aktivatory- sunt substanțe care măresc viteza reacției enzimatice.
1. Substanțele care afectează zona centrului activ. Acestea includ ioni metalici (Na +. + K. Fe 2+. Co 2+. Cu 2+. Ca2 +. Zn2 +. Mg 2+. Mn 2+, etc.). In unele cazuri, ionii metalici funcționează ca un cofactor enzimatic. In alte cazuri, ele promovează aderența substratului la situsul activ al enzimei. Ionii metalici sunt activatori numai în ceea ce privește deficienței lor în organism.
2. efectori Allosteric. care se leaga de o alosteric (reglementare) porțiunea apoenzimei. Această legare determină o modificare conformațională în molecula de proteină, rezultând într-o schimbare a structurii site-ului activ, care afectează conversia substratului și legarea în centrul activ. Când această activitate enzimatică sau crescută (acest alosterice activatori) sau scade (că inhibitorii alosterici). efectori alosterici enzime frecvent sunt diferiți metaboliți, și hormoni, ioni metalici, nucleozide - ATP, ADP, AMP.
3. Substanțe vyzyvayuschiemodifikatsii care nu afectează centrul activ al enzimei. Există mai multe opțiuni de astfel de modificări:
- activarea prin atasarea grupuri modificatoare specifice la molecula de enzimă. Exemplu: reglementarea Activitatea lipazei.
inactive ATP ADP O activă
─SN2 OH ─SN2 ─O─R─ON
În acest caz, gruparea fosfat atașată la grupările hidroxil ale aminoacizilor din proteine sunt parte a enzimei. Grupurile de fosfat încărcate negativ pot rupe hidrogen slab și legături ionice în structura terțiară a proteinei enzimei și influența starea conformațională a centrului său activ. În funcție de natura fosforilarii enzimei poate activa sau, alternativ, inactiva. reacția de adiție a unui grup de fosfat catalizată de enzima proteinkinază. și clivaj - fosfatazei. Activitatea acestor enzime, la rândul său, este controlat de sistemul hormonal.
- activarea putomperehoda precursoare inactive - proenzimei enzima activă datorită proteolizei parțiale.
Unele enzime sunt sintetizate în celula inițial inactivă după secreție din celulele merge într-o formă activă. precursori inactivi numit proenzime (zimogenii). Sub acțiunea unui activator se produce proenzimei hidroliza parțială cu eliminarea acesteia peptide inactive, prin care situsul activ se deschide. Deoarece activarea enzimelor tractului gastrointestinal, digerarea proteinelor alimentare. De exemplu, enzima pepsinogen. sintetizat în celulele din stomac, și apoi în lumenul stomacului prin acțiunea acidului clorhidric se transformă în pepsina activă prin ștergerea unei porțiuni inactive a lanțului polipeptidic:
HCl inactiv activ
pepsina, pepsinogen + peptidă
- Cauzele activatori de disociere subunităților enzimatice având structura cuaternară (scindarea uneia dintre subunități ale enzimei).
Ingibitoraminazyvayut activitatea enzimei vyzyvayuschiesnizhenie substanta. Ar trebui să se facă distincția inhibare și inactivarea enzimei. Simplul fapt că inhibarea reacției enzimatice în prezența unei substanțe care nu sunt încă spun că această substanță - inhibitor. Orice agenți de denaturare determina inactivarea enzimei și inhibarea reacției enzimatice. Inhibitorii, spre deosebire de agenți de denaturare acționează în concentrații mici și pot provoca o reducere specifică a activității enzimatice.
La puterea inhibitorilor de legare la enzima împărțit în reversibil și ireversibil. inhibitori ireversibili se leagă strâns la enzimă, în timp ce complexul enzimatic - inhibitor reversibil fragil. Dacă se diluează puternic soluție de enzimă cu un inhibitor reversibil, se descompune lor complexe și activitatea enzimei este restabilită.
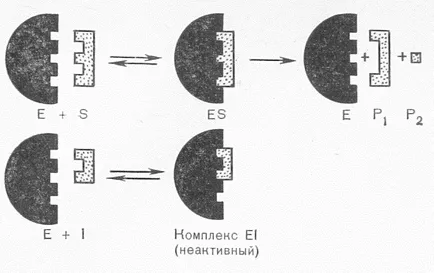
Pe mecanismul de acțiune al inhibitorilor pot fi împărțite în competitive și necompetitive. inhibitori competitivi sunt structural similare cu molecula de substrat care le permite să ia locul substratului în situsul activ al enzimei:
Înglobarea în loc de substrat în situsul activ, un astfel de inhibitor nu permite reacția enzimatică efectuată. Adică, substratul concurează cu inhibitorul pentru situsul activ. Cu site-ul activ se leagă la compusul a cărui molecule mai mult. Se îndepărtează inhibarea competitivă poate fi prin creșterea concentrației de substrat.
Pe principiul pe baza multor agenți de acțiune de inhibare competitivă farmacologice (de exemplu, sulfonamide), insecticide, agenți de război chimic organofosforice (Sarin, Soman).
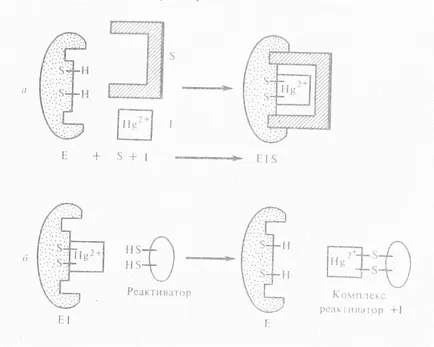
Inhibitorii necompetitivă nu au similaritate structurală cu substraturi. Ele fie se leaga de centrul catalitic al grupelor active ale enzimei, sau prin legarea enzimei site-ul activ este, schimba conformația locului activ astfel încât acesta previne conversia substratului. Ca un inhibitor necompetitiv nu afectează legarea substratului, în contrast cu inhibarea competitivă se observă formarea unui complex ternar:
Pentru inhibitorii necompetitivi includ ioni de metale grele: mercur, plumb, cadmiu și arsenic. Ei blochează SH-grupurile în situsul catalitic al enzimei. Eliminați efectul exces necompetitivă inhibitor al substratului, ca și la inhibarea competitivă, este imposibilă, și numai poate legare inhibitor (reactivator) substanțe. Metale grele numai în concentrații scăzute acționează ca inhibitori, în concentrații mari acționează ca denaturanți.
Cei mai importanți inhibitori necompetitivi sunt produse într-o celulă vie produse intermediare metabolice capabile de legare la siturile alosterice reversibil ale enzimei - inhibitorii alosterice. Ei ocupă o poziție-cheie în metabolismul, astfel cum reactioneaza subtil la schimbări în metabolismul și reglementează trecerea substanțelor pentru sistemul enzimatic întreg. De exemplu, reglarea allosteric inhibării se manifestă ca produs final al primului circuit enzimatic. Acest regulament este similar cu mecanismul de reglementare și feedback-ul permite controlul randamentul final al produsului, în cazul în care acumularea încetează operarea primelor Chains de enzime