3 Rata reacțiilor chimice
Reacțiile pot proceda la rate diferite. Viteza de reacție depinde în principal de natura reactanților și a condițiilor de reacție (concentrațiile de reactant, temperatură, presiune, etc.).
Reacțiile sunt numite omogene (o singură fază), în cazul în care moleculele reactive sunt într-o singură fază (lichid sau gazos). Astfel de reacții apar în întregul volum al sistemului și viteza sa este schimbarea măsurată în concentrația uneia dintre substanțele implicate în proces, pe unitatea de timp:
concentrația de C este exprimată în mol / l, și timpul t în minute sau secunde, astfel încât dimensiunea vitezei de reacție [mol / ls] sau [mol / lmin].
Numita reacție heterogenă dacă reactanții sunt în faze diferite. Acestea sunt la interfața în care reactanții vin în contact, iar viteza lor este măsurată de numărul n substanțe. care intră în reacție sau format prin reacția pe unitatea de timp pe unitatea de suprafață:
unde S - suprafață. Dimensiunea reacției eterogene [mol / m 2 s] sau mol / cm 2 s].
Viteza de reacție depinde de numărul de coliziuni între molecule de reactanți, care crește odată cu concentrația acestora. masa Zakondeystvuyuschih formulat după cum urmează:
La o temperatură constantă, viteza de reacție chimică este direct proporțională cu produsul concentrațiilor reactanților în grade, egal cu coeficienții ecuației reacției.
Pentru reacția procedând conform ecuației m A + n B = p C + q D, expresia matematică a legii acțiunii maselor are forma:
în care - viteza de reacție;
[A], [B] - concentrația reactivilor A și B;
m. n - coeficienții din ecuația reacției;
k - constanta vitezei (în funcție de temperatură și de natura reactanților, dar nu depinde de concentrațiile). Constanta de viteză este numeric egală cu viteza de reacție a reactanților la concentrații egale cu unitatea.
Atunci când concentrația de reacție heterogen de substanțe din faza solidă, este constantă și nu este inclusă în expresia legii acțiunii maselor.
Dependența vitezei de reacție la temperatură se determină pravilomVant Hoff. potrivit căruia
unde
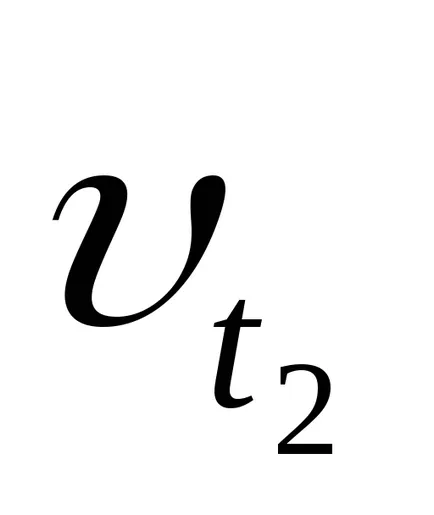
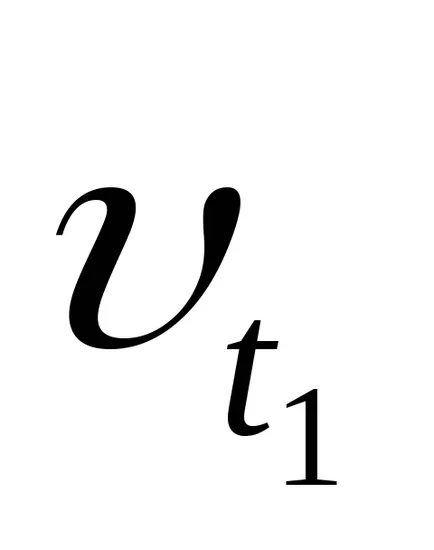
Coeficientul de temperatură - a vitezei de reacție. Acesta arată de câte ori viteza de reacție crește odată cu creșterea temperaturii cu 10 grade.
Energia în exces minimă în comparație cu media, care ar trebui să aibă o moleculă la reacția dintre ele a devenit posibilă, numită aktivatsiiEa de energie. Se calculează ecuația lui Arrhenius, dacă valorile constantelor de viteză
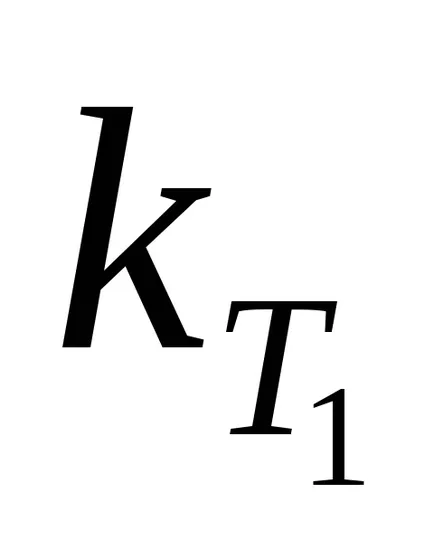

unde R - constanta universală a gazelor, egal cu 8,32 J / molK.
Example1. Cum se schimbă viteza de reacție 2NO + O2 = 2NO2. în cazul în care volumul amestecului de gaze pentru a reduce de trei ori?
Notăm concentrațiile inițiale ale reactanților [NO] = a. [O2] = b. Conform legii vitezei de reacție de acțiune în masă este egală cu modificarea volumului = ka 2 b.
După reducerea volumului sistemului omogen este de trei ori concentrația fiecăruia dintre reactanți pentru a crește de trei ori:
Conform noilor concentrații ale vitezei de reacție:
Prin urmare, viteza de reacție va crește cu 27 de ori.
Exemplul 2. Reacția dintre substanțele A și B curge prin 2A + B = C. Concentrațiile inițiale sunt egale cu ecuația [A] = 6 mol / l, și [B] = 3 mol / l. Constanta de viteză de reacție este egal cu 0,6 l 2 · mol -2 ∙ s -1. Se calculează viteza de reacție în momentul inițial și momentul în care amestecul de reacție rămâne la 40% din substanța A.
O astfel de problemă care se rezolvă prin utilizarea unui tabel în care contribuie n C - concentrațiile inițiale de substanțe; C - schimbarea lor în cursul reacției; C - concentrația substanțelor în timpul final, când amestecul de reacție va fi de 40% din materialul A care este 6 0,4 = 2,4 mol / l. Apoi, modificarea concentrației substanței A este 6-2.4 = 3,6 mol / l. Din ecuația reacției arată că substanțele A și B reacționează într-un raport de 2 1, astfel încât concentrația de B a scăzut la S = 3,6. 2 = 1,8 mol / l și a fost egal cu
Scriem legea acțiunii de masă pentru răspunsul nostru: = k 2 V A . Concentrațiile materiile prime sunt prezentate în tabelul:
Pe baza concentrațiilor inițiale și finale determinate ale vitezei de reacție înainte:
n = 0,6 3 2 = 64.8 luna iunie mol / l cu ; k = 0,6 2,4 2 1,2 = 4,15 mol / l cu .
Rezultatele de calcul arată că viteza de reacție scade cu timpul, pentru că substanțele consumate în timpul reacției.
Exemplul 3. De câte ori crește viteza de reacție cu creșterea temperaturii la 40 la 70 0 C, în cazul în care coeficientul de temperatură este egal cu 2?
Conform regulii de van't Hoff,

Prin urmare, viteza de reacție va crește de 8 ori.
Exemplul 4. Se calculează energia de activare a reacției, dacă constantele de viteză la 273 și 283 K, respectiv, 5 și 410 810 5 1.
Din ecuația Arrhenius energia de activare:
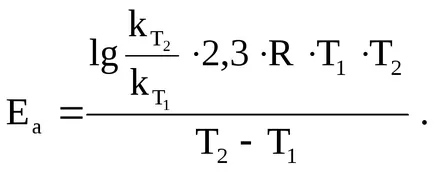
Substituind datele, obținem:
=
= 44353 J / mol = 44.35 kJ / mol.
41. Reacția merge din ecuația A (g) + 2C (g) C (z). Deoarece viteza de reacție se va schimba în cazul în care creșterea presiunii de 3 ori și ridică simultan temperatura la 30 0 C? Temperatura coeficientului vitezei de reacție este de 3.
Răspunsul: creștere de 729 de ori.
42. Reacția, conform ecuației 2A (g) + B (g) 2C (g). Deoarece viteza de reacție se va modifica când presiunea din sistemul de 2 ori și în același timp, scăderea temperaturii la 40 0 C? Temperatura coeficientului vitezei de reacție este de 2.
Raspuns: redus de 128 de ori.
43. Viteza de reacție a fost mărită de 243 de ori, coeficientul de temperatură este 3. În câte grade a fost ridicat temperatura?
Răspuns: 50 0 C.
44. Reacția are loc conform ecuației N2 + 3H2 2NH3. Deoarece viteza de reacție se va schimba în cazul în care concentrația de azot a crescut de 4 ori, iar concentrația hidrogenului - 2 ori?
A: creste de 32 de ori.
45. Reacția, conform ecuației 2A (g) + B (g) C. Concentrațiile inițiale ale reactanților (mol / l): CA = 0,8; SV = 0,6. Deoarece viteza de reacție se va schimba în cazul în care concentrația substanței în crescut la 0,9, iar substanța A - 1,2 mol / L?
Răspuns: va crește de 3,4 ori.
46. Reacția, conform ecuației 2A (g) + B (g) C. Concentrațiile inițiale ale reactanților (mol / l): CA = 2,5; CB = 8. După cum se va schimba viteza de reacție, în cazul în care concentrația de substanță A redus la 1,5, și B - până la 4 mol / l?
Răspuns: scădere de 5,6 ori.
47. Descompunerea 2O are loc conform ecuației 2N2 O = 2N2 + O2. Constanta de viteză este egală cu 5 ∙ 10 4 l / molmin. După ceva timp, concentrația 2O a fost egală cu 3 mol / l. Ce procent din descompuși N2 O, dacă raportul final de viteză este egală cu 0,36 inițială? Care este rata inițială a reacției?
A: 40%; 0,0125 mol / lmin.
48. Saponificarea acetat exprimată prin ecuația:
SOOS2 H5 CH3 + NaOH SOONa CH3OH + C2 H5. Pornind de concentrație ester 0,02 mol / l, 0,1 mol de alcalii / litru. După ceva timp au reacționat la 75% eter, iar viteza de reacție devine egală 4,2510 5 mol / lmin. Se calculează viteza de reacție inițială.
Răspuns: 4 mol 2,010 / lmin.
49. Reacția dintre substanțele A și B este exprimată prin ecuația 2A + B C. Constanta de viteză de 0,7 l 2/2 mol min. Concentrația inițială a substanței B este egală cu 0,6 mol / l. După 40% a reacționat materialul A. O concentrație a devenit egală cu 0,3 mol / l. Ia viteza inițială și viteza de reacție la momentul la care 40% din substanța reacționat A.
A: 0,105; 0,0315 mol / lmin.
50. Reacția dintre substanțele A și B, în conformitate cu veniturile 2A ecuații + B C. Concentrațiile inițiale ale reactanților (mol / l): SA = 6; CB = 5. Constanta de viteză este egală cu 0,5 l 2/2 s mol. Se calculează viteza unei reacții chimice în momentul inițial și momentul în care 45% din substanța va rămâne în amestecul de reacție.
Răspuns: 90; 0,28 mol / ls.
51. Reacția conform ecuației A (g) + 2C (g) C (z). Deoarece viteza de reacție se va modifica când presiunea din sistemul de 4 ori și coborârea simultană a temperaturii la 20 0 C? Raportul vitezei Temperatura este de 3.
Răspuns: scădere de 576 de ori.
52. Reacția conform cu 2A ecuații + B C. Concentrațiile de substanțe A și B sunt egale cu 0,5 și 0,1 mol / l. Se calculează constanta de viteză a reacției, în cazul în care viteza de reacție este 510 3 mol / lmin.
A: 0,2 l 2/2 mol min.
53. Cum se schimbă viteza de reacție care apar în faza gazoasă, în cazul în care creșterea este de trei ori mai mare: a) concentrația de O2. b) concentrația de HCl în presiune)?
Răspunsul: crește a) de 3 ori; b) 81 de ori; c) 243 de ori.
54. Reacția conform ecuației H2 (g) + I2 (g) 2NI (g). Constanta de viteză de reacție este egală cu 0,16 l / mols. Concentrațiile inițiale ale substanțelor au fost (mol / l):
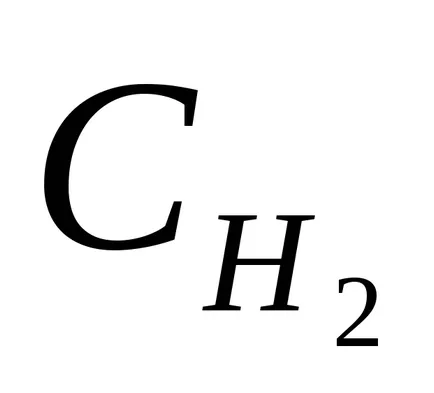
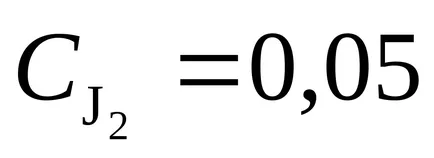

Raspuns: 3,210 4; 4 mol 1,910 / ls.
55. Reacția conform ecuației A + 2B C. Constanta de viteză este egală cu 0,4 l 2 / mol s 2, iar concentrația inițială (mol / l): SA = 0,3; SV = 0,5. Se calculează viteza de reacție la momentul inițial și după 0,1 mol reacționeze / l de compus A.
A: 0,03; 0,0072 mol / ls
56. Reacția conform ecuației 2N2 O = 2N2 + O2. Constanta de viteză de reacție este egal 510 4 l / molmin. Concentrația inițială de N2 O este egală cu 3,2 mol / l. Se calculează viteza de reacție în momentul inițial și momentul în care se descompune cu 25% N2 O.
Raspuns: 51,210 4; 4 mol 28,810 / lmin.
57-60. T1 constantă a vitezei de reacție la 0 ° C este egal cu k1. și la t2 0 C - k2. Energia de activare Ea kJ / mol. Se calculează valoarea indicată de întrebare.