1F · 1023 · 1
1F = 96500 = CI și 26,8 · h
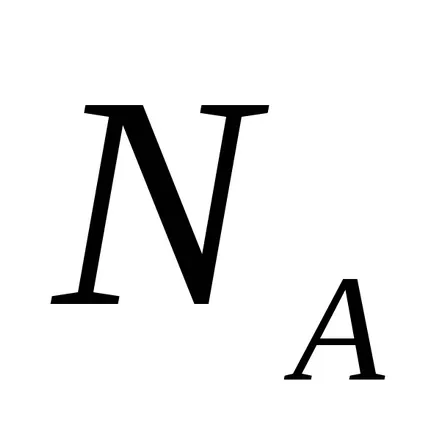

Dacă soluția este trecută prin electricitatea Faraday 1 (CI 96500), electrodul va sta pe substanță echivalentă 1 mol.
2. A doua lege a lui Faraday:
Conform legii a doua lui Faraday, la o anumită cantitate de energie electrică a trecut raportul de masă egală cu raportul substanțelor nereacționate echivalenții lor chimici.
Chemical membru echivalent este raportul dintre masa elementului care se atașează sau înlocuiește în compuși chimici per greutate atomică de hidrogen sau oxigen mase atomice jumătate la 1/12 din masa atomului C12.
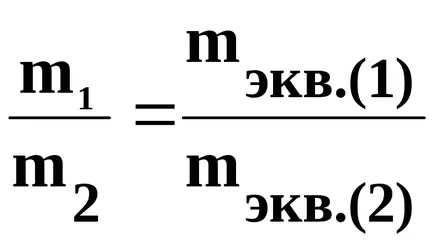
unde m1 - masa materialului (1) formate sau supuse unor substanțe de conversie: mekv1. - greutatea sa echivalentă; m2 - masa materialului (2) format. mekv2. - greutatea sa echivalentă;
3. combinat Legea lui Faraday:
Greutatea electrolit, netransformat în timpul substanțelor de electroliză și greutate formate pe electrozi este direct proporțională cu cantitatea de energie electrică a trecut prin electrolit și greutățile echivalente ale substanțelor.
Această lege este exprimată prin următoarea ecuație:

unde m - masa rezultată, sau supusă substanței de conversie: mekv. - greutatea sa echivalentă; I - intensitatea curentului, t - timpul în secunde, F = 96500 cl - numărul Faraday, (sau t - timpul în ore, apoi F = 26,8 Ah); BT - curent de ieșire.
Sau la calcularea volumelor de gaze eliberate:
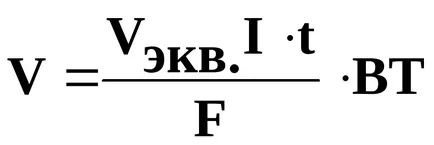
V - volumul gazului degajat (L); Vekv. - un volum echivalent (l / mol). Deoarece, în condiții normale, o cantitate echivalentă de hidrogen este de 11,2 l / mol și oxigen - 5,6 l / mol.
curent substanță Randament
In electroliza, poate curge mai multe reacții paralele - principale și lateral pentru a permite influența reacțiilor adverse, conceptul a fost introdus de „eficiență“. Eficiența actuală - raportul dintre teoretic necesare pentru a obține o anumită cantitate de energie electrică (în conformitate cu legea lui Faraday) practic cantitatea de energie electrică consumată. Pentru a reduce consumul de energie electrică pentru reacțiile secundare electrochimice și creșterea curentului tind să efectueze electroliză în aceste condiții în care descompunerea solventului este dificilă, adică, polarizare ridicată în timpul oxidării sau reducerea solventului (de exemplu supratensiune oxigen sau hidrogen). Acest lucru se realizează prin creșterea densității de curent, modificarea temperaturii electrolitului, selectarea materialului de electrolit și altele. D.
Eficiența actuală apreciază porțiunea din cantitatea de energie electrică a trecut, care cade pe această reacție electrod:
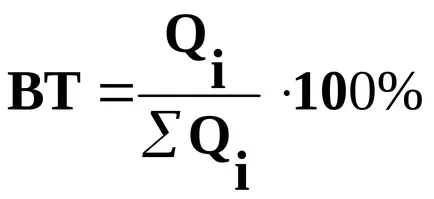
unde

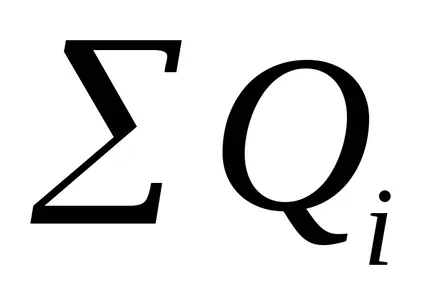
Eficiența actuală poate fi definită ca raportul dintre produsul rezultat al reacțiilor electrochimice (

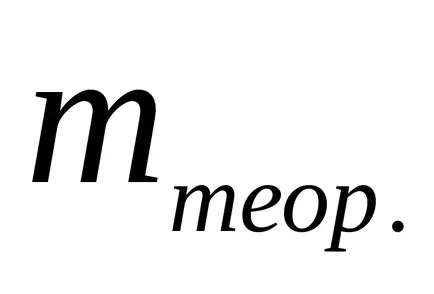
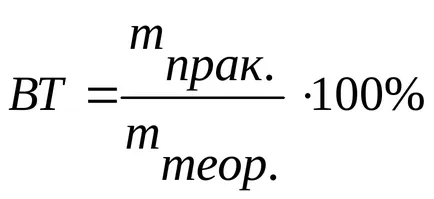
Există sisteme în care toată cantitatea de energie transmisă este consumată numai pe o singură reacție electrod, apoi VT = 1 sau 100%. Astfel de sisteme electrochimice utilizate pentru măsurarea energiei electrice și a trecut denumit „coulometria“.