Viteza medie a moleculelor
distribuție Boltzmann
Formula barometric, în raport cu M / R și împărțiți numărătorul și numitorul prin numărul lui Avogadro
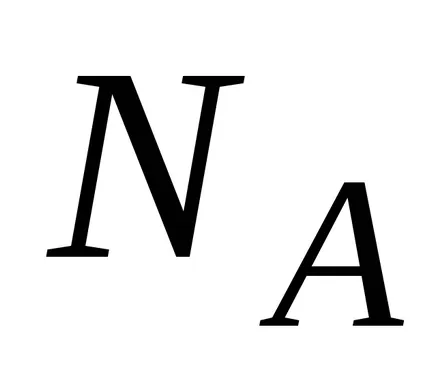
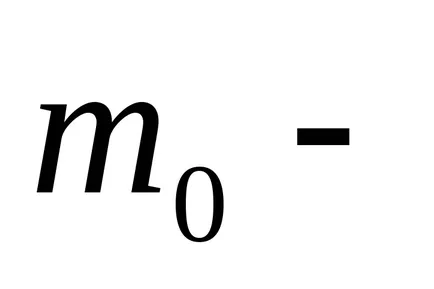
In schimb, R &
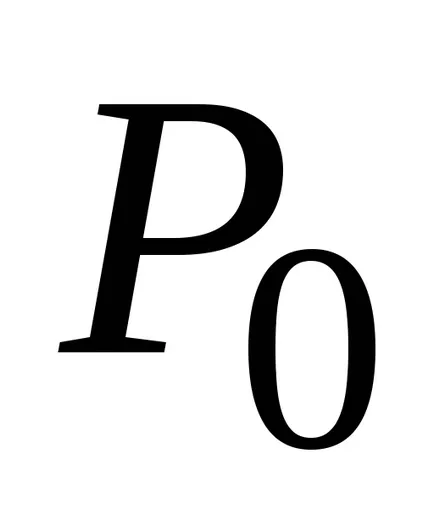
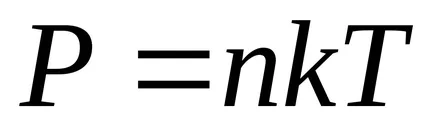
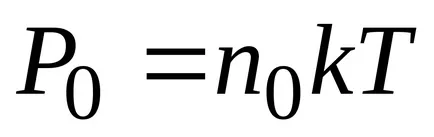
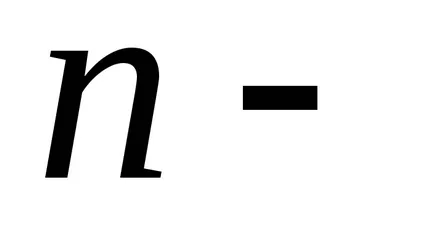
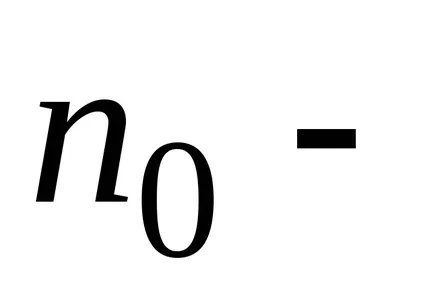
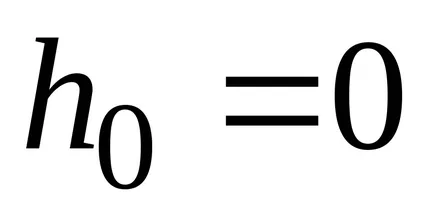
Dintr-un rezultat al barometrice formula substituiri și abrevierile obținerea distribuției concentrației moleculelor în înălțime în câmpul forța gravitațională a Pământului.
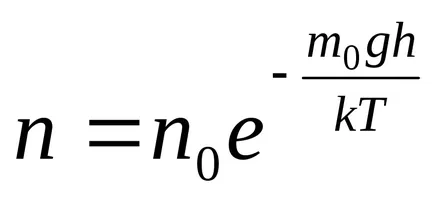
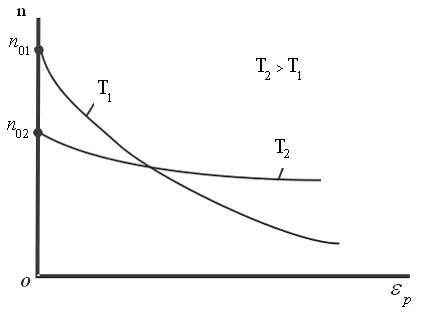
Din această formulă rezultă că temperatura scade numărul de particule la înălțimi diferite de zero, scade (fig. 8.10), referindu-se la 0 la T = 0 (la zero absolut toate moleculele au stabilit pe suprafața Pământului). La temperaturahnslabo de mare scade cu înălțimea, astfel încât
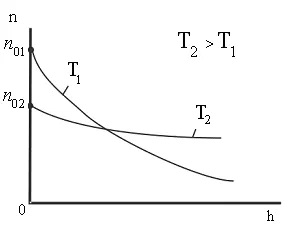
că moleculele sunt distribuite aproape uniform în înălțime. Distribuția moleculelor în înălțime este rezultatul concurenței între atracția moleculelor Pământului și mișcarea termică caută să arunce molecule în toate înălțimi. La înălțimi diferite molecule are o varietate de rezervă energie potențială
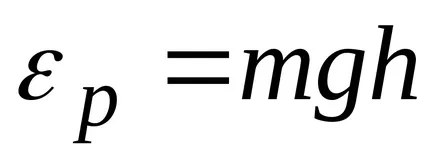
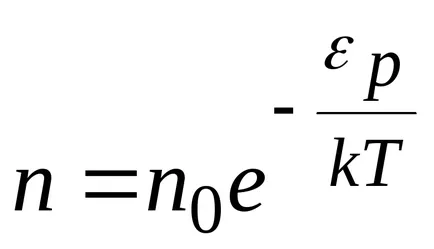
unde
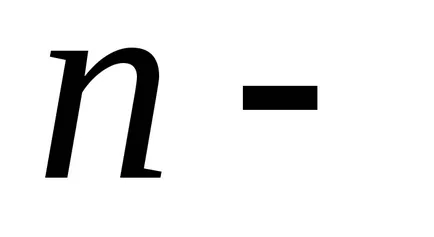
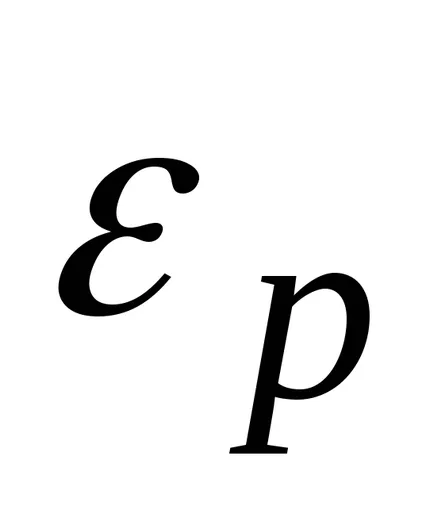
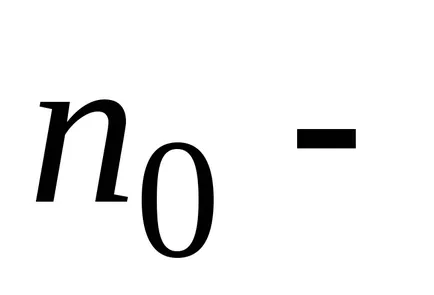
Boltzmann a arătat că distribuția (*) nu este adevărat numai în cazul unui câmp potențial forța gravitației terestre, dar, de asemenea, în orice domeniu potențial forță pentru orice combinație de particule identice într-o stare de mișcare termică aleatoare.
Astfel, legea Boltzmann (*) dă distribuția particulelor într-o stare de mișcare termică haotică, în conformitate cu valorile potențialului energetic. (Fig. 8.11)
distribuția Boltzmann la nivele de energie discrete.
Distribuția Boltzmann rezultată se aplică în cazurile în care moleculele sunt într-un câmp extern și energie potențială a acestora
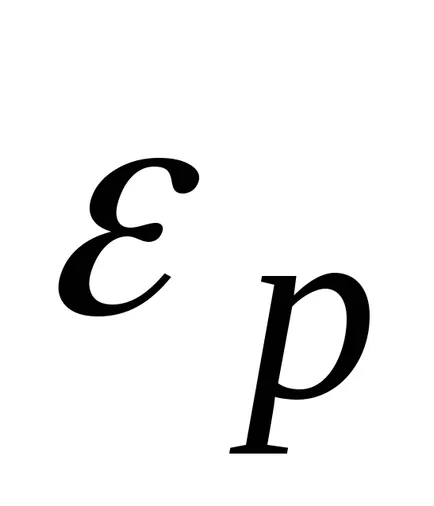
un set discret de valori permise este cunoscut faptul că valoarea energiei interne a moleculei (sau atom) G poate lua
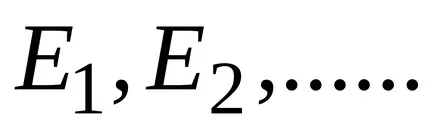
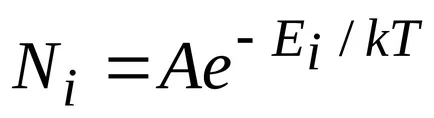
unde
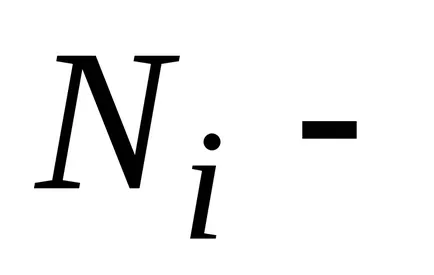
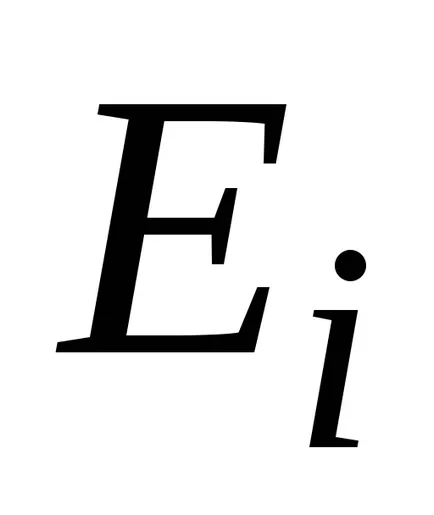
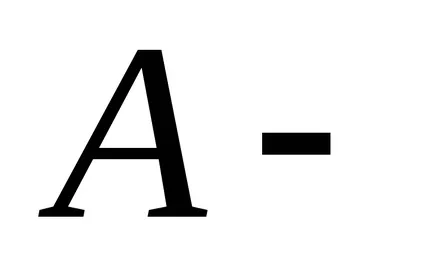
,
unde N - numărul total de particule din sistem.
atunci
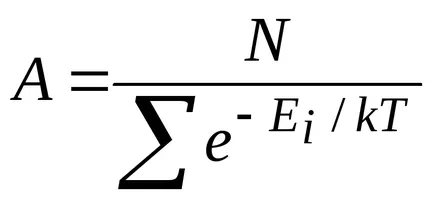
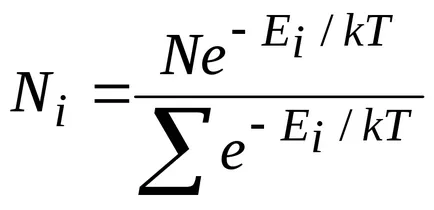
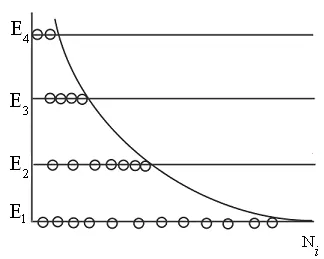
ilustrare Calitatea acestei distribuții este prezentată în Fig. 8.12. Această distribuție este caracteristică stării de echilibru termodinamic.
Rețineți că în mediul activ de lasere niveluri populate cu o valoare mare de energie poate fi mai mare decât cu mici. Această așa-numitele niveluri ale populației inverse.
Dar starea sistemului, în acest caz, echilibrul termodinamic.
distribuția lui Maxwell și Boltzmann pot fi combinate într-o singură lege Maxwell-Boltzmann, în care numărul de molecule, componente ale vitezei, care se află între
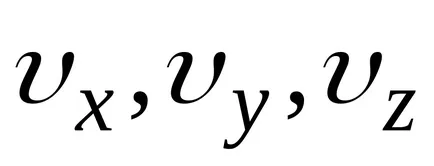
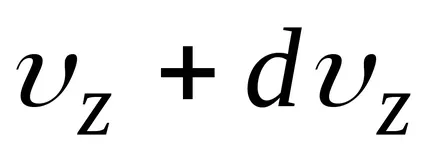

în cazul în care,
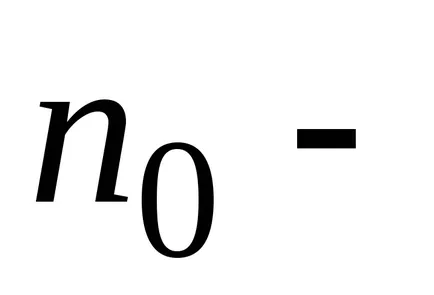
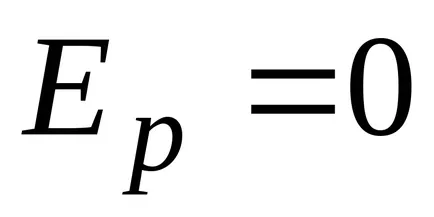
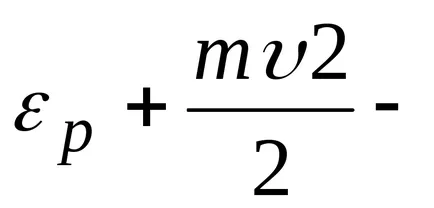
distribuția Maxwell-Boltzmann determină distribuția moleculelor de gaz la coordonatele și vitezele în prezența unui câmp de forță potențial arbitrar.
Notă. distribuție Maxwell și Boltzmann sunt părți integrante ale unei singure distribuție, numită distribuție Gibbs (această problemă este discutată în detaliu într-un curs special privind fizica statistică, și ne limităm la menționarea acestui fapt).
Întrebări pentru auto-control.
Dă definiția probabilității.
Care este sensul funcției de distribuție?
Care este sensul condiției de normalizare?
Formula record pentru determinarea valorii medii a rezultatelor măsurătorilor de x utilizând funcția de distribuție.
Care este distribuția Maxwell?
Care este funcția de distribuție Maxwell? Care este sensul fizic de ea?
Se trasează funcția de distribuție Maxwell
Precizați graficul
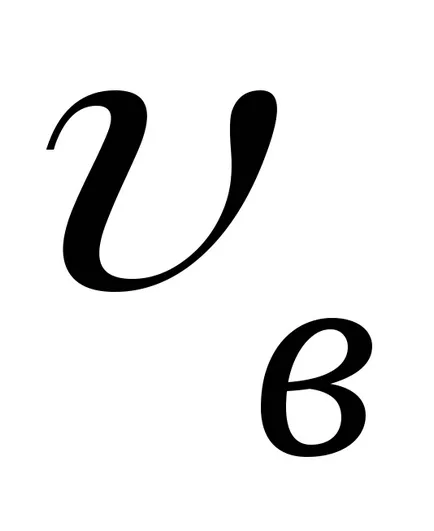
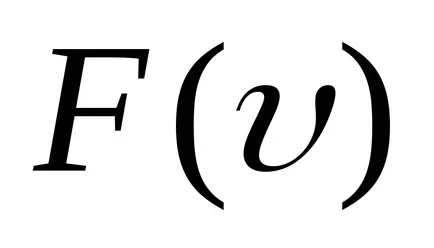
Primiți formula barometrică. Ce a determinat-o?
Ia dependența moleculelor de gaz în concentrație de înălțime gravitației.
Se înregistrează distribuția Boltzmann a) Pentru o molecule de gaz ideale în câmpul gravitațional; b) masa m de particule, care sunt în rotor centrifugă rotativă cu viteză unghiulară

Explica sensul fizic al distribuției Maxwell-Boltzmann.