Valorile posibile numere cuantice
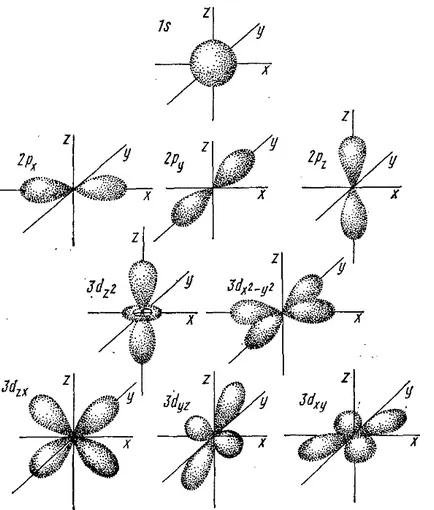
Figura 5. Forma orbitalii de electroni
Al patrulea număr cuantic, numit numărul cuantic de spin și este notată cu ms. Ea poate avea două valori: +1/2 și -1/2. ms caracterizează momentul cinetic propriu (moment unghiular) a unui electron.
Umplerea electroni orbitali de electroni de atomi mulți electroni
ecuația Schrödinger face posibilă calcularea cu precizie energia electronului în sistemul cu un singur electron (atom de hidrogen). Pentru a permite atomilor elementelor rămase, că orbitalii electronice sunt la fel ca și un atom de hidrogen, iar umplerea acestor orbitali cu electroni se realizează pe trei principii: consum energetic redus și regula Pauli Hund lui.
Acesta a acceptat structura cochilii de electroni de atomi scrise sub forma de formula electronică sau electronică grafică. La completarea straturilor electronice ale atomilor în stare staționară (neexcitat) a menținut principiul minimei energie a electronului. conform căruia:
Starea cea mai stabilă a electronului într-un atom corespunde la minimum a energiei potențiale a electronului.
Prin urmare, umplerea straturilor de electroni pornind de la nivelurile caracterizate prin cea mai mică energie. Creșterile de energie de electroni ca valoarea principalului și a numerelor cuantice orbitale (n + l) (prima regula Klechkovskii). Dacă valorile sunt aceleași, primul electron orbital este umplut cu o valoare mai mică a numărului cuantic principal (a doua regulă Klechkovskii) (fig.6) două orbitali sum (n + l).
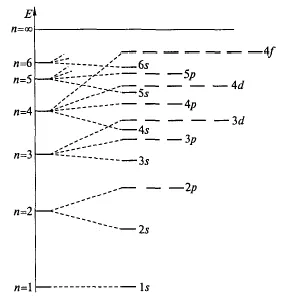
Figura 6. Schimbarea orbitali de electroni de energie
Ordinea de umplere orbitalii electronilor după cum urmează:
1 S 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
Principiul (interdicție) Pauli
Atomul nu poate fi doi electroni cu aceeași valoare a tuturor celor patru numere cuantice.
Rezultă că, în fiecare orbital, caracterizate prin valori definite ale n principal, l și orbitală numerele cuantice magnetice ms pot fi nu mai mult de doi electroni ale căror spini sunt opuse în semn. Doi electroni sunt în același orbital (și caracterizate prin spin opus), denumite asociat. Spinii o direcție paralelă și se numește oppositely regia - antiparalel. Principiul Pauli face posibilă calcularea numărului maxim de electroni în fiecare nivel de energie și subnivel în atomul (Tabelul 9). Numărul maxim de electroni la subnivel cu numarul cuantic orbital este 2 l (2l + 1).
Structura fiecărui strat de electroni depinde de valoarea numărului cuantic principal. Astfel, K-strat (n = 1) este format din doar unul s-orbitali; L-strat (n = 2) conține una 2s-orbital și trei 2p-orbital; M-strat (n = 3) constă dintr-un 3s-orbital, trei 3p-orbitali și cinci 3d-orbitali etc strat electronic capacitanță determină numărul maxim N de electroni în stratul de electroni descris formula ..:
unde n - numărul cuantic principal.
Calculat în conformitate cu această formulă numărul maxim de electroni din fiecare strat este egal cu: 1 pentru strat - 2, 2 straturi - 8, pentru 3 straturi - 18, pentru un strat de 4 - 32 de electroni.
Amplasarea straturilor și orbitalii de electroni se numește configurație de electroni (formula). În cazul în care înregistrările de configurare a valorii electronice punctul a numărului principal cuantic, apoi - literele s, p, d, f - numărul cuantic orbital, iar scrisoarea de pe partea din dreapta sus - numărul de electroni în acest orbital. Secvența de umplere orbitali de electroni de diferite straturi electronice pot fi reprezentate după cum urmează: