Teoria moleculară-cinetică

Pornind din secolul al XVIII-lea, a început treptat să dezvolte un sistem de idei stiintifice despre structura materiei, numit mai târziu teoria moleculară-cinetică (ICB). Teoria moleculară-cinetică se bazează pe trei poziții, care sintetizează rezultatele unui număr mare de date experimentale:
Toate corpurile sunt compuse din particule minuscule - atomi, molecule și ioni. Astfel, orice substanță are o structură discretă.
Particulele care formează substanțe sunt în mișcare aleatoare constantă, care se numește căldură.
Atomi, molecule și ioni interacționează unele cu altele.
Luați în considerare situația în detaliu.
Structura moleculară a substanței. Mol de substanță. Numărul lui Avogadro. Cantitatea de substanță.
Fizica modernă nu stabilește limite de divizibilitate structurală a materiei, cu toate acestea, afirmă în mod clar că elementele care definesc proprietățile fizice de bază ale organismelor sunt atomi, molecule și ioni.
Atom este cea mai mică particulă a unui element chimic dat fiind proprietățile sale purtătoare. Fiecare element chimic are propriul atom.
Molecule - cea mai mică particulă stabilă a substanței având proprietățile sale chimice de bază. Molecula constă din atomi de elemente chimice identice sau diferite.
Ion - particule încărcate electric, care este format prin pierderea sau achiziționarea atomilor și a moleculelor de unul sau mai mulți electroni.
Structura atomica sunt gaze inerte (heliu, argon, etc.), lichide (mercur) și solide (cupru, diamant). O serie de substanțe cristaline, cum ar fi clorura de sodiu, este compus din ioni incarcati oppositely. Cu toate acestea, marea majoritate a substanțelor este format din molecule (dioxid de carbon, apă), astfel încât termenul „molecula“ este adesea folosit ca un termen colectiv comun.
tehnică experimentală modernă permite observarea structurii moleculare a substanței, precum și pentru a determina dimensiunea atomilor și moleculelor. Aceste dimensiuni sunt foarte mici: atomii sunt de ordinul 10-10 m, la moleculele de gamă mult mai largă - 10-10 m pentru molecule simple la 10-5 m pentru molecule complexe de substanțe organice.
Firește, cu astfel de dimensiuni, masa atomilor si moleculelor este, de asemenea, foarte mici, de exemplu, masa moleculei de hidrogen este de 3,3 · 10-27 kg. Se înțelege că funcționează cu astfel de valori nu este foarte convenabil în calculele practice.
Prin urmare, conceptul (atomic) greutate moleculară relativă a fost introdusă dl, care este definit ca raportul dintre masa moleculei (atom) substanței 1/12 atomului de carbon în masă m0 :. (1)

Numărul de molecule în cazul sistemului cu un component. conținând molecule sau atomi de o specie pot fi găsite prin formula:
, unde m - masa sistemului, exprimată în kilograme.
Din această formulă se observă că N are o valoare foarte mare, astfel încât introducerea unui parametru relativ necesar asociat cu numărul N de molecule din sistem, numit cantitatea de substanță.
Sistemul Internațional de Unități (SI), ca un astfel de parametru transferat mol - cantitatea de substanță care conține același număr de molecule sau atomi, ca atomi conținute în 0,012 kg de carbon.
Astfel, un mol de orice substanță conține același număr de molecule sau atomi, care se numește numărul (o constantă) și este egală cu lui Avogadro:
Cantitatea de substanță n este definită ca numărul de moli egal cu numărul de molecule relativ la numărul lui Avogadro N :. (2)
Greutatea unui mol dintr-o substanță numită greutate moleculară. Este egal cu produsul dintre masa unei molecule de substanță m0 după numărul lui Avogadro: M = m0 · NA (3)
și măsurată în kilograme per mol: [M] = kg · mol-1.
De la (1), (3) și definiția numărului lui Avogadro, rezultă că între greutatea moleculară Mr substanță relativă și raportul său de masă molară M există: M = Mr · 10-3 kg · mol-1.
Având în vedere m egalitatea = N · m 0 unde m - masa materialului în conformitate cu formulele (2) și (3), este ușor să se obțină o altă expresie pentru cantitatea de substanță: (4)
t. e. cantitatea de substanță egală cu masa substanței la masa molară.
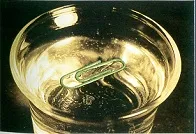
Moțiunea termică a moleculelor. Confuzie, mișcare haotică a particulelor - cea mai importantă caracteristică a mișcării termice. dovezi experimentale ale naturii continue a mișcării moleculare este difuzie și mișcarea browniană.
Diffusion - o penetrare spontană fenomen de molecule de o substanță la alta.
Ca rezultat al difuziei reciproce a substanțelor este o aliniere progresivă a concentrației acestora în toate domeniile de volum pe care îl ocupă.
Sa stabilit că rata procesului de difuzie depinde de tipul și temperatura substanțelor difuziune. Una dintre cele mai interesante fenomene care confirmă mișcarea haotică a moleculelor este mișcarea browniană. Este o mișcare termică microscopic (dar constând dintr-un număr foarte mare de molecule) substanță sub formă de particule în suspensie într-un lichid sau un gaz, P. Browne a observat mai întâi. mișcarea Confuzia a unor astfel de particule, datorită faptului că suma impulsurilor primite de acestea din molecule din părți diferite pot fi non-zero, ca urmare a unor numere diferite de accidente vasculare cerebrale din diferite părți ale particulei, iar rezultatul a particulei pe de o parte ar putea lovi molecule având mai mult decât viteza de molecule, a lovit-o pe de altă parte. mișcarea browniană se manifestă mai accentuat, mai mici particule și viscozitatea mediului, și cu cât temperatura sistemului. Dependența de temperatură indică faptul că viteza mișcării aleatoare a moleculelor crește odată cu creșterea temperaturii, motiv pentru care se numește mișcare termică.
Interacțiunea dintre molecule. forțe intermoleculare sunt electromagnetice în natură și poate fi redusă la două tipuri - atracție și repulsie. Aceste forțe sunt cu rază scurtă și apar numai la distanțe comparabile cu dimensiunile moleculelor. Forțele atractive și respingătoare scădea rapid odată cu creșterea distanței dintre molecule, dar rata lor de scădere variază. forța repulsie domină la distanțe mici și pe termen nelimitat crește pe măsură ce se apropie de distanța r dintre centrele de masă ale moleculelor la o anumită valoare a d. care poate fi privit ca un diametru molecular eficient. Forța de atracție scade odată cu creșterea r mult mai lent respingătoare forță, astfel încât există o anumită valoare în distanța r = r0 intermoleculară. în cazul în care repulsie și forțele de atracție se anulează reciproc, astfel încât forța rezultantă a interacțiunii intermoleculare devine zero.
Schimbarea de starea de agregare a substanței