Sunt amine a) metilamină; b) dimetil amină; c) amină trimetil
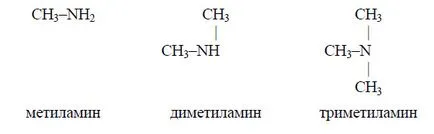
Principalele proprietăți ale aminelor, ca amoniac datorită prezenței la atomul de azot singură pereche de electroni. Prin urmare, mai mare densitatea de electroni pe atomul de azot, cu atât mai pronunțată proprietățile de bază ale aminei. Într-o moleculă de atom metilamina azot este legat la radicalul metil. Electronegativitate de hidrogen este mai mică decât carbon și azot, astfel încât deplasarea electronilor de la trei atomi de hidrogen la un atom de carbon și apoi - la atomul de azot (indicată prin săgeți)
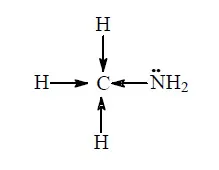
Ca rezultat, densitatea de electroni pe atomul de azot este crescută și metilamină este o bază mai puternică decât amoniacul. Într-o moleculă de atom de hidrogen dimetilamină legat la doi radicali metil, și se transferă la un atom de azot, densitatea de electroni de șase atomi de hidrogen, cu toate acestea, densitatea de electroni pe atomii de azot decât în molecula de metilamină, dimetilamină și este o bază mai puternică decât metilamină. În cele din urmă, în molecula trimetilamina trei radical la atomul de azot metil, iar electronul este deplasată la atomul de azot de nouă atomi de hidrogen. Prin urmare, trimetilamina este, la rândul său, o bază mai puternică decât dimetilamină. Astfel, proprietățile principale metilamina sunt cele mai slabe, în timp ce trimetilamina - cel mai greu.