Structura terțiară a proteinei
Această dispunere spațială α-helix lanț polipeptidic sau într-o structură tridimensională (conformație). Forma structurii terțiare a proteinelor este împărțită în globulară (sferic) și fibros (filamentoasă).
Obligațiunile care stabilizează structura terțiară sunt formate între radicalii amino laterale și grupările funcționale ale acestora. Link-uri poate fi puternic (covalente) și slab (polar și van der Waals).
legături hidrofobă (van der Waals), ionice și hidrogen sunt slabe, dar deoarece acestea sunt repetate de mai multe ori in proteine care joaca un rol important în formarea structurii terțiare.
Atunci când stabilește structura terțiară a α-helix, sau un lanț polipeptidic al proteinei tinde să devină energetic (termodinamic) formă avantajoasă, caracterizată printr-un minim de energie liberă. In amino acizii radicali de legătură hidrofobe, evitând formă de apă van der Waals legături în interiorul moleculei de proteină, și grupările hidrofile ale aminoacizilor sunt situate în apropierea suprafeței exterioare și leagă apa. In centrul Globula de proteine practic fără apă și coajă hidrat se formează pe suprafața sa.
Atunci când stabilește structura α-helix terțiară dobândește o anumită formă în spațiul tridimensional (Fig. 5).
Fig. Schema 5. spațială
Structura proteină globulară
Tipuri de obligațiuni implicate în formarea structurii terțiare a proteinei (fig. 6).
- legătură hidrofobă (van der Waals) - se formează între hidrofob (nepolară) radicali amino;
- legături de hidrogen - sunt formate între radicali de aminoacizi polari neîncărcate;
- legături ionice sau electrostatice - sunt formate între radicali de aminoacizi încărcate polar.
legături puternice (covalente).
- o legătură disulfidică - se formează între cele două molecule de cisteină
- Pseudopeptidă (lozhnopeptidnaya) bond - se formează între gruparea carboxil a radical amino și un radical cu un alt aminoacid amino;
- legătură ester - se formează între gruparea hidroxil a serinei sau treoninei și radicalii carboxil ai acizilor glutamic și aspartic.
In ultimul deceniu, oamenii de știință au descoperit ca in celula sunt proteine specializate si proteine enzimatice care reglează procesul de pliere a lanțurilor polipeptidice nou sintetizate în structura terțiară nativă corectă. Printre acestea se numără:
- peptdil enzima-prolil-cis / isomerase trans - duce la formarea cis conformația legăturii peptidice formate de atomul de azot al pralinei, care determină rotația lanțului polipeptidic de aproximativ 180 (la locul regularității lanț polipeptidic al α-helix este rupt);
- enzimă proteindisulfidizomeraza - catalizate legături disulfurice de clivaj format incorect și formează noi S-S legături, caracteristica proteinei native.
- chaperone și chaperonins - este catalitica proteine inactive (deschis L.Ellis) - „familie de proteine,“ ajuta corecta asamblare necovalentă a unei conformație tridimensională a proteinei și pentru a preveni formarea de structuri de proteine inactive funcțional. Chaperones Sinteză crește brusc cu expunerea la stres a temperaturii, astfel încât acestea sunt numite „proteine de șoc termic“. Chaperones deține lanțul polipeptidic nou sintetizat pe ribozomului într-o stare desfășurată, și chaperonins asigură condițiile pentru formarea singura structura terțiară corectă a proteinei.
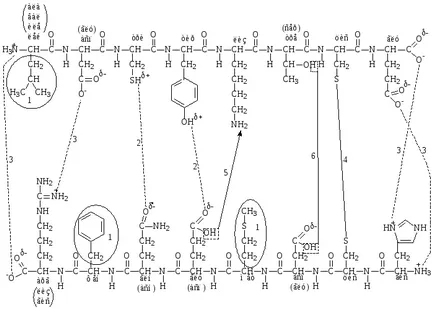
Fig. 6. Contact implicat în formarea structurii terțiare a proteinei