Structura și principiul de funcționare a celulei electrochimice - studopediya
Metal cufundat într-o soluție de electrolit numit electrod. Electrozi - un sistem de două corpuri conductoare - conductoare din primul si al doilea fel. Prin primul tip conductori includ metale, aliaje, oxizi metalici conductibile, precum și materiale nemetalice, cum ar fi grafit; purtatori de sarcin - electroni. Pentru conductorii de al doilea tip sunt soluții de electrolit și se topește; purtatori de sarcin - ioni. Un dispozitiv format din doi electrozi, numite celule electrochimice.
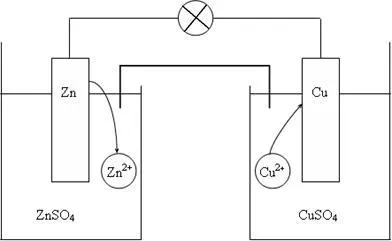
Fig. 2. Circuitul de celule galvanice de cupru-zinc
Să considerăm un element galvanic Jacobi-Daniel (schema prezentată în Fig. 2). Se compune dintr-o placă de zinc, cufundat într-o soluție de sulfat de zinc și o placă de cupru, cufundat într-o soluție de sulfat de cupru. Pentru a preveni interacțiunea directă între electrozii de oxidant și reducător separate printr-un perete despărțitor poros.
Într-o celulă galvanică electrodului realizat din metal mai activ, adică, din metal, aflată în partea stângă în seria electrochimică, numit anod. iar electrodul este realizat din metal mai puțin activ - catod.
Pe suprafața electrodului de zinc (anod) strat electric dublu, și un echilibru se stabilește:
Ca rezultat al acestui proces se produce un potențial de electrod de zinc.
Pe suprafața electrodului de cupru (catod) ca strat electric dublu, și un echilibru se stabilește:
Rezultatul este un potențial de electrod de cupru.
Deoarece potențialul electrodului de zinc are o valoare mai negativă decât potențialul electrodului de cupru, apoi prin închiderea circuitului extern, adică compus cu zinc pentru metal conductor de cupru, electronii se vor deplasa de zinc la cupru. In acest proces, echilibrul la electrodul de zinc este deplasat spre dreapta, astfel încât soluția intră ioni suplimentari de zinc. În același timp, soldul din electrod de cupru se va deplasa spre stânga și descărcarea ionilor de cupru.
Astfel, prin închiderea circuitului extern produce procesul de dizolvare spontană a zincului la electrodul de zinc și recuperarea cuprului din electrod de cupru. Aceste procese vor continua atâta timp cât potențialele sunt aliniate sau nu pentru a dizolva toate zinc sau cupru electrod teren pe toată cuprul.
Deci, atunci când se utilizează celule-Jacobi Daniel apar următoarele procese:
1. Procesul anodic, procesul de oxidare:
Zn 0 - 2 # 275; → Zn2 +.
2. Procesul de catod, procesul de recuperare:
Cu 2+ + 2 # 275; → Cu 0.
3. Mișcarea electronilor în circuitul extern.
4. Mișcarea ionilor în soluție: SO4 2- anioni la anod, cationii de Cu 2+ la catod. Mișcarea ionilor în soluție completează circuitul electric al celulei electrochimice.
Rezumând reacția de electrod, obținem:
Zn + Cu 2+ = Zn 2+ + Cu.
Ca rezultat, curgerea reacției are loc într-o mișcare celulară a electronilor într-un circuit extern și ioni în interiorul elementului, adică, curent electric. Prin urmare, o reacție chimică totală care apare în celulă, numita reacție de curent formatoare.
Curentul electric din celula se datorează reacției redox are loc astfel încât procesele de oxidare și de reducere sunt separate spațial: electrodul negativ (anod) are loc procesul de oxidare la electrodul pozitiv (catod) - procesul de recuperare.
O condiție necesară pentru funcționarea celulei electrochimice este o diferență de potențial între electrozi. Maximum diferență de potențial de electrod, care poate fi obținută în timpul funcționării celulei electrochimice, numită o forță electromotoare (emf) a elementului. Acesta este egal cu diferența dintre potențialul catodului și potențialul anodic al elementului:
elementul EMF este considerat pozitiv dacă are loc reacția de formare a curentului în această direcție în mod spontan. emf pozitivă corespunde o anumită ordine și în circuitele unității de înregistrare: stânga electrod înregistrat trebuie să fie negativ. De exemplu, elementul-Jacobi Daniel schema este scris ca: