Starea excitată unui atom

Acasă | Despre noi | feedback-ul
Starea excitată a atomului - stat instabil energetic în care atomul merge să dea energie din exterior. In starea excitată, atomul este doar o perioadă scurtă de timp poate locui. atom de Emoționat, dând energie se întoarce la starea de sol.
Interacțiunea, în caz contrar legătura acceptor donor-acceptor-donor; bond coordonare - punerea în reacție, pe baza transferului de încărcare sau transferul de electroni de la donator la acceptor pereche.
Donatori aktseptoronoe interacțiune include cazurile taxa de transfer între moleculele donor și acceptor, fără formarea de legături chimice între ele și se transferă perechea de electroni unshared de donator la acceptor, având ca rezultat formarea unei legături.
În primul caz, acesta poate fi, de exemplu, un donator organic, în particular - Donor, de exemplu, tetrakis (dimetilamino) etilen (TDAE), alți compuși aminici nesaturați, metaloceni, etc. și acceptori organici cum ar fi fullerene sau acceptor quinodimethane .. substituenți. În reacția unor astfel de compuși complexați cu transfer de sarcină, în care acceptorul încărcat negativ și pozitiv interacționează donor încărcat electrostatic. Un rol important este jucat un astfel de sistem, în cazul în care în transferul electronic taxa de stat la sol este doar parțială, atunci statul cu transfer de aproape complet de încărcare poate fi produs prin photoexcitation. Astfel de sisteme, diads donor-acceptor și triade, în care între donor și acceptor introdus grupă punte contribuie la starea de durata de viață a transferului de încărcare poate fi folosit pentru crearea de dispozitive de conversie a energiei solare (vezi. De exemplu, fotosinteza artificială). În general, transportul de încărcare în diferite forme și manifestările sale, joacă un rol-cheie în multe procese biologice.
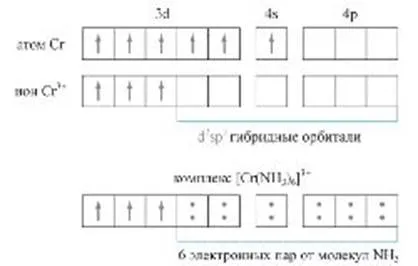
În al doilea caz, donatorul și acceptor sunt, respectiv, un acid și o bază Lewis. Dacă legătura covalentă normală între doi atomi comuni din cauza formarea de perechi de electroni - unul din fiecare atom, legătura donor-acceptor este realizată printr-o pereche de donor de electroni și libere (neumplute) orbitalii acceptor. Acest tip de interacțiune donor-acceptor - procesul de bază pentru formarea compușilor complecși (Fig.). O astfel de interacțiune este responsabil pentru multe conversie acido-bazic, asociată cu transferul de ioni de hidrogen (acceptor), precum și formarea de nanostructuri supramoleculare.
Directivitate legătură covalentă este rezultatul atomilor de aspirație, pentru a forma o legătură puternică, cel mai probabil datorită densității electronilor mai mari între nucleele. Acest lucru se realizează printr-o orientare spațială a suprapunerii norilor de electroni, care coincide cu propria lor. Excepția este norii s-electroni, deoarece forma lor sferică face toate direcțiile egale. Pentru norii p- și d-electroni se suprapun se realizează de-a lungul axei pe care acestea sunt extinse și formate în legătură cu aceasta se numește # 963; -bond. # 963; -Comunicare are o simetrie axială și doi atomi poate fi rotit de-a lungul legăturii, adică, că o linie imaginară care trece prin miezul de atomi legați chimic.
După formarea între doi atomi # 963; -bond la restul norilor de electroni de aceeași formă și cu același număr cuantic principal * rămâne doar posibilitatea de suprapunere laterală pe ambele părți ale legăturii. Rezultatul este un π-bond. Este mai puțin puternică decât # 963; -Comunicare: suprapunere apare orbitalii difuze ale porțiunilor laterale. Fiecare legătură multiplă (de exemplu, dublu sau triplu) conține întotdeauna un singur # 963; -bond. număr # 963; -bonds care formează atomul central în moleculele sau ionii complecși, valoarea acesteia definește numărul de coordonare. De exemplu, o moleculă de NH3 și NH4 + ion pentru atom de azot este egal cu trei și patru. formare # 963; -bonds fixează poziția spațială a atomilor în raport cu celălalt, astfel încât numărul de # 963; -bonds și unghiurile dintre liniile de racordare, care sunt numite unghiuri de valență determina moleculele de configurație geometrică spațială.
La evaluarea gradului de suprapunere a norilor de electroni ar trebui să fie considerate semne ale funcțiilor de undă ale electronilor *. Când suprapunerea de nori cu aceleași semne ale funcțiilor de undă ale densității de electroni în spațiul dintre miezuri crește. În acest caz, există o suprapunere pozitivă, ceea ce duce la nuclee de atracție reciproce. Dacă semnele funcțiilor de undă ale opuse, densitatea norului de electroni este redus (suprapunere negativă), ceea ce duce la repulsia reciproca a nucleelor.
Ionic legătură - caz special covalentă atunci când perechea de electroni format este deținută integral de atomul mai electronegativ devenind anion. Baza de selecție în această privință, un anumit tip este faptul că compușii cu o astfel de legătură poate fi descrisă în aproximația electrostatic, presupunând o legătură ionică cauzată de atracția ionilor pozitivi și negativi. Interacțiunea ionilor de semn opus nu depinde de direcția și forța Coulomb nu are proprietatea de saturație. De aceea, fiecare ion din compusul ionic atrage un număr de ioni de semn opus, pentru a forma rețea cristalină de tip ionic. Într-un moleculele de cristale ionice acolo. Fiecare ion este înconjurat de un anumit număr de ioni de semn opus (numărul de coordonare al ionului). perechi de ioni pot exista în stare gazoasă, sub formă de molecule polare. Gazos NaCl are un moment de dipol
3 # 8729; 10 -29 CI # 8729; m, ceea ce corespunde unei deplasări de încărcare de 0,8 electroni pe lungimea legăturii de 0.236 nm pentru Na CI, adică Na CI 0,8- 0,8 + ...
În plus față de diverse relații heteropolare și du-te-meopolyarnyh, există un alt tip special de comunicare, care, în ultimele două decenii a atras atenția tot mai mare de chimiști. Aceasta se numește o legătură de hidrogen. Sa constatat că atomul de hidrogen poate forma o legătură între doi atomi de electronegative (F, O, N, CI și mai puțin S). Există cazuri când această legătură formează un atom de hidrogen legat la un atom de carbon în compuși de tip NSKH3, în care X - atom electronegativ sau grup (de exemplu, HCN, fluorocarburi). Deși în prezent natura legăturii de hidrogen nu este încă pe deplin înțeles, odna.ko reprezentare definită tridimensională a este deja posibil să se facă.
Legătura de hidrogen se formează între atomii electronegative din care cel puțin una are o pereche electron liber, de exemplu:
legături de hidrogen (notat în fantomă a trei puncte).
Astfel, legătura de hidrogen este, prin natura, aparent, electrostatic; este format prin atracția legată covalent de electroni liberi de protoni ai altor atomi de molecule. In acest caz, protonul nu este în mijloc între ele de legare (chiar dacă acestea sunt aceleași) atomii, și mai aproape de atomul de care este legat covalent. De exemplu, în cazul apei
una distanță egală cu O-H 0,99 A și 1,76 A. Alte
Problema dacă hidrogenul este într-o poziție fixă sau oscilează între două poziții de echilibru, în cazul general este încă neclar, deși studiul de quinhydrone trasor indică poziția fixă a legăturii de hidrogen din acest compus este reprezentat de hidrogen.
energia de legare a hidrogenului este mică; este de ordinul a 5-10 Kcal / mol, în timp ce, de exemplu, energia normală de comunicare O-H este de 109 kcal / mol, iar comunicarea H-F 148 kcal / mol. La topirea gheții rupe aproximativ 15% din legăturile de hidrogen prin încălzirea apei la 40 ° C timp de legături de hidrogen breaks aproximativ jumătate. Aburul de legături de hidrogen este aproape deloc. După topire, legăturile de hidrogen sunt alcooli rupte puțin, dar ele sunt complet rupte în timpul evaporării lor. Acizii car slick, legături de hidrogen nu sunt rupte, iar evaporarea, astfel încât, de exemplu, acid formic într-o fază de vapori există ca dimer
Cu toate acestea, în acest caz, o legătură de hidrogen de energie este de numai aproximativ 7 kcal / mol.
Prezența legături de hidrogen are un efect semnificativ asupra proprietăților fizice ale compușilor. Aceasta înseamnă că legăturile de hidrogen sunt responsabile pentru asocierea de apă și alcooli, și, prin urmare, punctul lor de fierbere anormal de ridicat relativ, de exemplu, cu hidrogen sulfurat și mercaptani. Capacitatea de alcooli, amine, acizi carboxilici, amide se dizolvă în apă, datorită formării de legături de hidrogen cu moleculele de apă. Anumiți compuși, cum ar fi esterul atsetouksus-Nogo formă enolică, o-nitrofenolul, și altele. Forma legături de hidrogen intramoleculare cu ciclul de închidere. Studiul legăturilor de hidrogen ar trebui să facă lumină suplimentară asupra structurii și proprietăților multor substanțe organice.
beriliu Fluorul Be F (2) - un material sticlos. Structura sa este format dintr-o retea dezordonata de atomi de beriliu (CN 4), conectate prin punți de atomi de fluor, și similar cu cel din sticlă de cuarț. Deasupra 270 ° C fluorură de beriliu cristalizat spontan. La fel ca și cuarțul, există în temperatură scăzută, o formă care este la 227 ° C, intră în b-forma. Puteți obține, de asemenea, sub formă de cristobalit și tridimit. similarități structurale între SiO2 și BeF2 se extinde și la fluoberyllates (care sunt formate prin reacția cu fluorură de beriliu fluoruri de elemente alcaline și amoniu) și silicați. Beriliul fluorură - component de sticlă fluoberyllate și amestec de sare utilizată în reactoarele nucleare, sare topită.
O moleculă de apă este format din doi atomi de hidrogen (1 H) și un atom de oxigen (16O). Se pare că aproape toate proprietățile diversității de apă și manifestările lor neobișnuite se determină, în cele din urmă, natura fizică a acestor atomi, metoda lor de asociere și gruparea în molecula formată considerate separat molekul.V molecula de apa de hidrogen si oxigen atomi, sau mai degrabă miezurile lor sunt dispuse astfel încât să formeze un triunghi isoscel. In partea de sus a acesteia - un miez relativ mare de oxigen din colțuri adiacente bazei, - un nucleu vodoroda.V conform structurii electronice a atomilor de hidrogen și oxigen molecula de apa are cinci perechi de electroni. Ele formează un nor de electroni. Norul este neomogen - este posibil să se distingă condensarea și rarefierea individuală. La baza oxigenului creează un exces de densitate de electroni. pereche de electroni internă a oxigenului înconjoară uniform nucleul: acesta este reprezentat schematic un cerc centrat - core O2-. Patru electroni exterioare sunt grupate în două perechi de electroni, gravitează la miez, dar nu parțial compensat. Schematic, orbitalii totale de electroni ale acestor perechi sunt prezentate ca elipse ce se extind dintr-un centru comun - nucleu O2-. Fiecare dintre cele două oxigen rămase formează o pereche de electroni de la un atom de hidrogen electron. Aceste perechi sunt atrase de nucleul de oxigen. De aceea, nucleele de hidrogen - protoni - sunt oarecum goale, și aici există o lipsă de plotnosti.Takim electronice, cei patru poli ai tarifelor se disting într-o moleculă de apă: două negative (un exces de densitate de electroni în nucleul de oxigen) și două pozitive (lipsa densității de electroni în cele doua nuclee de hidrogen ). Pentru o mai mare claritate, ne putem imagina că polii ocupă vârfurile tetraedrul deformate, centrul, care este un nucleu de oxigen