solide amorfe
solide amorfe în multe dintre proprietățile lor și mai ales pe microstructurii trebuie văzută ca un lichid foarte racim cu o viscozitate foarte ridicată. Structura acestor organisme se caracterizează numai prin ordine rază scurtă în aranjamentul particulelor. Unele dintre aceste substanțe nu sunt în măsură să cristalizeze: ceară, ceară de etanșare, rășină. Alt mod de răcire la o anumită formă de structuri cristaline, dar în cazul răcirii rapide inhibă creșterea vâscozității în aranjamentul ordonare a particulelor. Substanța se solidifică înainte de începerea procesului de cristalizare se realizează. Acestea sunt numite corpul sticloasă: sticlă, gheață. Procesul de cristalizare într-o astfel de substanță poate să apară și după solidificare (opacifierea sticlă). solide amorfa și includ materiale organice: cauciuc, lemn, piele, plastic, lână, bumbac și fibre de mătase. Procesul de tranziție a acestor substanțe din faza lichidă a unui solid este prezentată în Fig. - curba I.
corpurile amorfi au temperaturi de solidificare (topire). Graful T = f (t) are un punct de inflexiune, care se numește punctul de înmuiere. Scăderea temperaturii duce la o creștere treptată a viscozității. O astfel de natura tranziției în stare solidă, determină lipsa de substanțe amorfe căldura specifică de topire. Tranziția inversă când căldura este furnizată, există o înmuiere netedă la o stare lichidă.
Un solid cristalin.
O trăsătură caracteristică a microstructurii cristalelor este periodicitatea spațială a câmpurilor electrice interne și repetabilitatea în locația particulelor de cristal - atomi, ioni si molecule (ordine rază lungă). Particulele sunt alternate într-o anumită ordine de-a lungul liniilor drepte, care sunt numite noduri. În orice secțiune plan de cristal două linii care se intersectează astfel de sisteme formează o pluralitate de paralelograme identice care strâns fără goluri acoperă secțiunea plan. În spațiul de intersecția a trei sisteme necoplanare astfel de linii formează o rețea spațială care împarte cristalul într-o multitudine de paralelipipede identice. linie punct de intersecție, formând o rețea cristalină sunt numite noduri. Distanțele dintre noduri de-a lungul unor traduceri de direcție numite sau perioade. Grilajul Paralelipiped dreptunghic construite în trei emisiuni non-coplanare se numește o celulă de unitate sau de repetabilitate zăbrele paralelipiped. O proprietate geometrică importantă este simetria barilor de cristal în aranjamentul particulelor în ceea ce privește anumite direcții și avioane. Din acest motiv, deși există mai multe moduri de selectare a celulei unitate a structurii cristaline pentru aceasta, este selectată astfel încât aceasta să corespundă simetria zăbrele.
corpul cristalin pot fi împărțite în două grupe: cristale unice și policristale. Pentru monocristale observate în volumul singur cristal cu zăbrele a întregului corp. Deși forma exterioară a unui tip de cristale singulare pot fi diferite, unghiurile dintre fețele vor fi întotdeauna la fel. O trăsătură caracteristică a cristalelor singulare este anizotropia Proprietăți mecanice, termice, electrice, optice și altele..
Cristale singulare sunt adesea găsite în stare naturală în natură. De exemplu, cele mai multe minerale - cristal, smaraldele, rubinele. În prezent, în producție pentru multe cristale unice crescute artificial din soluții și se topește - rubine, germaniu, siliciu, galiu arseniura.
Unul și același element chimic pot forma mai multe diferite în geometrie, structurile cristaline. Acest fenomen se numește - polimorfism. De exemplu, carbon - grafit și diamant; gheață cinci modificări și altele.
de tăiere și anizotropie proprietăți exterioare corespunzătoare, de obicei, nu apar pentru solide cristaline. Acest lucru se datorează faptului că solide cristaline de obicei constau din mai multe cristale mici orientate aleatoriu. Aceste solide sunt numite policristaline. Acest lucru se datorează mecanismului de cristalizare: atunci când condițiile necesare pentru acest proces, cristalizare au loc simultan în focarele o multitudine de locații ale fazei inițiale. Cristalele nucleate sunt aranjate și orientate una în raport cu cealaltă este complet arbitrară. Din acest motiv, la finalul procesului obținem un solid sub formă de conglomerate fuzionate cristale mici - cristalitelor.
Din punct de vedere energetic, diferența dintre cristaline și amorfe solide bine urmărite în timpul de solidificare și de topire. solide cristaline având punctul de topire - temperatura este stabilă atunci când există substanță în două faze - (. curba 2 din figura), un lichid-solid și. Mutarea molecule solide în lichid înseamnă că dobândește încă trei grade de libertate de mișcare de translație. astfel unitate de masă a substanței cu punct de topire. în faza lichidă are o energie internă mai mare decât aceeași greutate în faza solidă. Mai mult, schimbarea distanței dintre particule. În general, prin urmare, cantitatea de căldură necesară pentru a converti o unitate de masa de material cristalin în lichid este:
unde λ - căldura specifică de topire a (cristalizare), (Uj -Ukr) - diferența de energie internă a fazelor lichide și cristaline, P - presiunea externă (Vl -Vkr) - diferența de volume specifice. Conform ecuației Clapeyron - temperatura de topire Clausius depinde de presiunea:

Este evident că, dacă (Vl -Vkr)> 0,
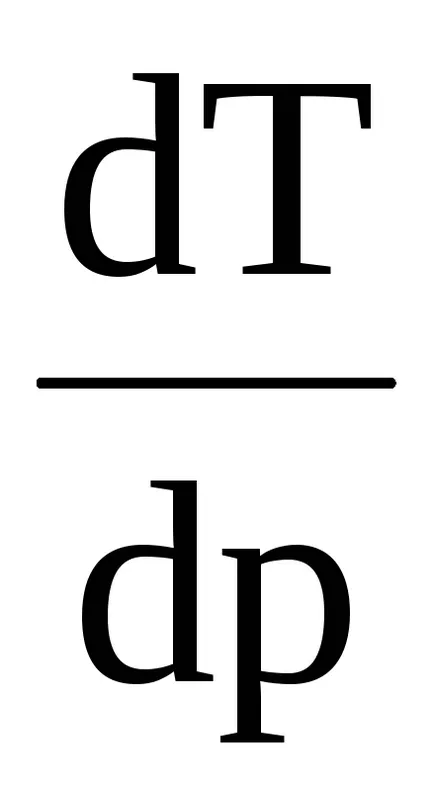
In solide amorfe de topire fără căldură. Încălzirea determină o creștere graduală a ratei de mișcare termică și reduce vâscozitatea. Graficul are un punct de inflexiune al procesului (Fig.) Care este numită convențional punctul de înmuiere.
Proprietățile termice ale solidelor
mișcare termică în cristale datorită interacțiunii puternice a particulelor este variații în jurul zonelor de cristal cu zăbrele limitate numai. Amplitudinea acestor oscilații nu sunt, de obicei, se transformă 10 -11 m, adică Este doar 5-7% din perioada de grilaj de-a lungul direcțiilor respective. Natura acestor fluctuații este foarte dificil, așa cum este determinat de forțele de interacțiune între particula oscilantă cu toți vecinii săi.
Creșterea temperaturii înseamnă creșterea energiei cinetice a particulelor. Aceasta, la rândul său, înseamnă o creștere a amplitudinii mișcării particulelor și explică de expansiune solide cristaline prin încălzire.
unde lt il0 - dimensiunile liniare ale corpului și la temperaturaht 0 0 0 C, alfa - ent-coeficienți de dilatare liniară. Pentru solide α este de ordinul a 10 ~ 5 - 10 -6 K -1. Ca urmare a expansiunii liniare este crescut, iar volumul corpului:
aici β - coeficientul de expansiune volumetrică. β = 3α o expansiune izotrop. corp monocristalin fiind anizotrope, au trei valori diferite ale α.
Fiecare particulă are trei oscilează grade de libertate de mișcare de vibrație. Având în vedere că pe lângă particulele cinetice posedă, de asemenea, un potențial energetic într-un singur grad de libertate particule solide trebuie să fie atribuită energia ε = kT. Acum, pentru energia internă va avea o aluniță:
și pentru capacitatea termică molară:
Ie căldură molar solide cristaline chimic simplu identic și independent de temperatură. Aceasta este legea Dulong-Petit.
Experimentele au arătat că această lege este destul de bine îndeplinite, pornind de la temperatura camerei. Explicații abateri de la legea Dulong-Petit la temperaturi scăzute au fost date de Einstein și Debye căldura specifică în teoria cuantică. S-a demonstrat că energia necesară pentru un grad de libertate nu este constantă, dar depinde de frecvența de temperatură și de oscilație.
Cristale Real. DEFECT Cristalele
Cristale Real au o serie de tulburări ale structurii ideale, care sunt numite defecte de cristal:
a) defecte punctuale -
defecte Schottky (particule site-uri neocupate);
defecte Frenkel (deplasarea particulelor nodurile din internoduri);
impurități (atomi străini introdus);
b) liniar - margine și dislocările cu șurub. Acest neregulate locale
STI în aranjamentul particulelor
din cauza planurilor atomice individuale neterminate
sau din cauza neregularităților în secvența dezvoltării lor;
c) joncțiune - limite între cristalite, rânduri de dislocații liniare.