Sare și cristalizarea de sulfat de sodiu
Împreună cu clorura de sodiu, există un număr mare de alte săruri care pot face obiectul unor experiențe de interese. Ia acid sulfuric, care nu-o rezistență chimică mai scăzută decât hidroxidul de sodiu, o picătură din ei a scăzut pe o mână, pro-plumb provoacă durere acută și arsuri severe; o bucată de lemn în cazul în care este cufundat în acest acid, aproape imediat carbonizate.
Dacă un amestec de acid sulfuric cu 49 până la 30 de fracțiuni de hidroxid de sodiu, se va-prin extrem de puternică reacție care însoțește Xia creștere semnificativă a temperaturii. După răcirea substanței obținute amestecului care poate dura fără nici un pericol: acidul este unit cu alcalii caustice și lor reciproc TION consumate. Dintre acestea, sare semi-chilas, cunoscut sub numele, logo-ul sernokis hidroxid (sulfat de sodiu). Acesta-nu exercita nici un efect pe hârtie de turnesol și nu are nici o asemănare cu substanța-mi, din care sa dovedit.
Chimia sare - un compus yuschiesya randament datorită reacției dintre dulce-jucărie și o bază alcalină sau. Sărurile demon-numerice. Unele dintre ele, ca sulfatul de oxid de cupru, potasiu hromovokis-ly - posedă o culoare caracteristică Coy; altele, cum ar fi sulfatul de sodiu, - incolor.
Ultima dintre aceste substanțe, cum ar fi săruri de porțiune de durere de gât pot primi de cristal-cristal-forma: în cazul în care se dizolvă într-o fierbere-ke și se lasă soluția în repaus, atunci va începe în curând pentru a forma transparenta, prismă foarte frumos. Această substanță Glauber în mod deschis și că este uneori numită sare urlet Glauber.
sulfat de sodiu aparține sărurile sunt foarte solubile în apă. Cel mai bun sulfat de sodiu se dizolvă la o temperatură de 32,4 ° C, cu creșterea și descreșterea tempera-runde scade. Dacă se toarnă stratul de greutate la o suprafață de soluție saturată de sare SFA-uberovoy, apoi atâta timp cât lichidul este în repaus, nici formarea cristalelor are loc în acesta; dar ar trebui să fie cufundat într-o cursă merge pe o baghetă de sticlă, și cristalizarea începe imediat (Fig. 116).
Fig. 116. Vasul care conține o soluție suprasaturată de sulfat de sodiu, a cărui cristalizare este prezentată în partea dreaptă a figurii.
Acest fenomen interesant devine și mai evidentă dacă o soluție caldă concentrată a fost plasată într-un tub subțire de sticlă și AB-ku lipit ultimul alcool Llamas ne după acestea prin fierbere aer expulzat (Fig. 117).
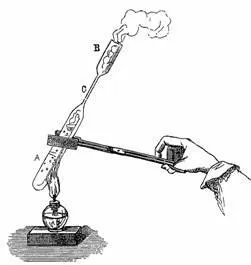
Fig. 117. Prepararea soluției suprasaturate sulfat de sodiu.
In acest fel, o soluție de hidroxid de etanșat sulfat tub dă cristale chiar la 0 °, mănăstire nesmot că o cantitate refrigerată locat-ditsya lichid de sare este de zece ori mai mare decât cea care poate fi dizolvat în ea la această temperatură. Dar este necesar doar pentru a rupe capătul tubului, și cristalizarea are loc imediat.