Ribozimele ca medicamente
Pe baza rezultatelor experiență de vizionare, precum și alte cunoștințe acumulate de părere ribozimelor a evoluat cu privire la posibilitatea de a folosi ribozime de a reglementa activitatea anumitor gene umane. Domeniul de aplicare a ribozomilor ca medicamentele pot fi foarte larg. Posibilele domenii de utilizare în clinici sunt în prezent în vedere tratamentul infecțiilor virale, cancere, pentru care sunt cunoscute produse ale oncogenelor, precum și stări patologice cauzate de supraexpresia genelor specifice.
O altă abordare pentru depășirea infecției cu HIV este scindarea structurii capacului 5'terminal al ARN HIV prin ribozime. Este cunoscut faptul că majoritatea izolatelor HIV secvență lider 5'-terminal al ARN-ului genomic a fost înalt conservată. Dintre toate tulpinile cunoscute ale tulpinii MN conține doar o singură substituție de nucleotidă în regiunea lider ARN ribozomal scindabil. În același timp, tulpini HIV examinate variază în alte porțiuni ale secvenței leader 5'-terminală. îndepărtarea Endonuclease ca parte a oligonucleotidă 5'-terminal al grupării plafonarea ARN HIV suprimă translația ARN-ului și a face mai accesibile nucleaze intracelulare țintă. Toate datele experimentale disponibile ne permit astăzi să facă o concluzie cu privire la perspectivele de utilizare a capătului 5“al secvenței lider al ARN HIV, ca o tinta pentru ribozime.
Principala dificultate de a fi depășite în proiectarea ribozomilor scindează ARN HIV genomic este ridicat mutabilitatea a ARN-ului. Datorită mutației singură substituție de nucleotidă în site-uri, care scindează ARN ribozomal, acesta din urmă își pierd activitatea lor în ceea ce privește aceste RNAs și activitatea în consecință antivirale. Cea mai recentă strategie în abordarea acestei probleme este de a crea mai multe ribozimelor îndreptate împotriva diferitelor regiuni conservate ale genomului HIV, ribozimele individuale trebuie incluse într-o moleculă de ARN recombinant ( „pusca secventierea“). În plus față de secvențe de ribozimă antivirale astfel RNAs recombinante conțin cis -action ribozime suplimentare care realizează procesarea precursorilor antivirale ribozimă autocatalitice cu eliberarea de ribozimelor mature care acționează pe diferite porțiuni ale genomului viral. Această metodă nu permite virusului HIV, pentru a evita o acțiune de inactivare a ribozomilor de mutației schimbă genomul său.

Fig. II.26. Folosind situsuri de restricție pentru construirea unei ribozime, un ARN antisens este integrat în
Recent, casetă a fost obținută de la nouă genă ribozyme identice aranjate unul în spatele celuilalt, în același vector de expresie. Ribozimele un astfel de ARN „policistronici“ îndreptate împotriva diferitelor părți ale genomului HIV, menținute în specificitatea sa de celule, dar au fost mai eficiente în ceea ce privește o singură copie a poliribozima ARN-ului și nu-și pierde activitatea chiar și în moleculele de ARN parțial degradate.
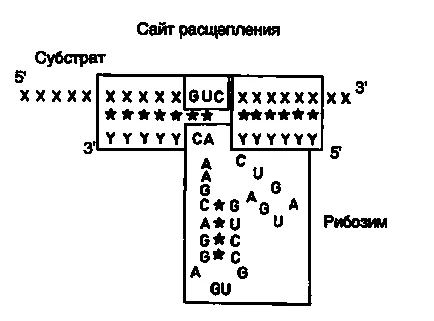
Fig. II.27. Interacțiunea cu substrat ARN ribozomal
În încheierea acestei secțiuni, considerăm un exemplu de utilizare a ribozomilor împotriva virusurilor de plante în agricultură. După cum sa menționat mai sus, ribozime, formând un tip de structură „Hammerhead“ recunosc locul de scindare în secvența de ARN țintă de trei nucleotide adiacente se produce o catenă de ARN hidroliză. Secvențele trinucleotidice similare pot fi AUC, CUA, CUC, GUA, GUC, GUU și CUS. În abordarea propusă, domeniul de legare a ARN al ribozima este construit în așa fel încât o parte recunoscută a secvenței trinucleotide de nucleotide în ADN dublu catenar care formează un situs de restricție. Această abordare face posibilă încorporarea secvenței ribozyme domeniului catalitic al situsului de restricție în cADN-ul obținut prin transcripție inversă a ARN-ului țintă. Prin urmare, domeniul catalitic al ribozima este flancat de secvențe de ARN antisens complementare ARN-ului țintă care efectuează în mod automat rolul de domeniu de legare ARN. În această abordare elimină necesitatea pentru sinteza unui număr mare de oligonucleotide, și, în orice caz, este necesar ribozimă este asamblat din blocuri prefabricate. Ca un exemplu specific, ia în considerare construirea unei ribozime recombinant scindeze în mod specific ARN care cuprinde secvența unui situs de restricție Sal I (Fig. II.26). După scindarea ADNc cu o enzimă de restricție Sal I (etapa 1) rezultați „lipicios“ se termină nucleaza hidrolizată S1 (etapa 2) și a format domeniu catalitic cu ribozimă „blunt“ capete inserate închise în fragmentul ADN dublu catenar (etapa 3). Ca rezultat al acestui design este sintetizat transcriind ARN antisens, care este inclusă în componența domeniului catalitic al ribozimă. După hibridizare cu forme de ARN țintă dublu catenar molecula de ARN, din care una este formată prin lanțuri de structură ribozimei tip „Hammerhead“ (Fig. II.27), clivarea ARN țintă la un situs specific. Abordarea descrisă a fost implementată în proiectarea unei ribozime împotriva genomului ARN virusurilor de prune. Astfel sa obținut secvența ribozima de nucleotide adecvate pentru utilizare cu alte situri de restricție 25.
Suprimarea funcției oncogene. Una dintre principalele diferente detectate intre celulele normale si canceroase sunt diferente genetice de mai multe gene care controleaza proliferarea. In genomul celulelor tumorale adesea prezintă mutații în genele de două tipuri: oncogene și gene supresoare tumorale de crestere, sau anti-oncogene. Oncogenele conservate evolutionarily și induc transformarea neoplazică a celulelor, atât în infecția retrovirală în condiții naturale (deoarece acestea sunt adesea încorporate în genomul retroviral), iar după introducerea oncogene ADN în celule de cultura prin transfecție. Cele mai multe oncogene a fost inițial detectat în compoziția genomului de virusuri oncogene, și ei sunt derivați de mutante protooncogenelor care sunt prezente in celulele sanatoase de organisme multicelulare și sunt activate în timpul embriogenezei, creșterea celulară și regenerarea tisulară. Deoarece oncogene activate in celulele tumorale, de obicei, supraexprimate și ARN codificat datorită structurii lor primare se deosebește de protooncogene ARN, oncogene ARN sunt o tinta potential bun pentru ribozime.
Oncogene H-ras. Mutația în codonului 12 genei H-ras. determinând înlocuirea GGCGUC creează site-ul la un consens cu privire la care HH-ribozima poate scinda ARNm-mutant. In vitro a fost demonstrată printr-o diferență de cinci ori în eficacitatea ribozimei în ARN H-ras mutante și ARN de tip sălbatic corespunzătoare. Obținem H-ras linie celulară -dependente transformată stabil cu un vector de expresie care direcționează sinteza HH-ribozimei sub controlul unei gene promotor -actină. Pentru aceste celule a redus rata de proliferare caracteristică, cuplată cu scăderea nivelurilor intracelulare de ARN H-ras și proteina p21 codificată de această genă. În continuare ribozim exprimat în linia celulară EJ carcinom de vezică urinară uman. Introducerea de celule stem la soareci a fost însoțită de moartea lor rapidă pe fondul unor tumori foarte invazive. In contrast, clonează EJ celulele care exprimă ribozima în corpul șoarecilor au redus dramatic fenotipul tumoral. Tumorile rezultate au fost minim invaziva, si a fost observat la creștere de aproximativ două ori a supraviețuirii șoarecilor grefate. Studiile histologica capacitatea slaba a tumorilor la metastaza. Tumorile Ribozimele au fost detectate prin PCR pentru 86-90 zile. Astfel, acestea și alte experimente au demonstrat capacitatea de ribozime a normaliza expresia activat H-ras atat in vitro cat si in vivo.
Onkogenc-FOS. După cum sa menționat în partea I, proteina produs gena c-fos este implicată în celulele eucariote semnal de transmisie, implicate în sinteza ADN-ului și poate da rezistență celulelor la medicamente impotriva cancerului. Ultimele două proprietăți ale acestei proteine sunt confirmate, în special în faptul că, în timpul tratamentului cu cisplatină anticancer medicament frecvent utilizat (cis-diamminedichloroplatinum) are loc genei c-fos inducție după gene dTMP-sintetazei și ADN polimerază. Un ribozim care perturba ARNm-c-fos reduce nivelul expresiei genice al final c-fos. a dus la o sensibilitate crescută a celulelor tumorale la agenți chimioterapeutici (inclusiv cis-platină) și a suprimat semnificativ expresia genelor dTMP-sintaza ADN polimeraza și gena metalotioneinei uman hMTII-A.
Oncogene bcr / abl. Aberanta cromozom Philadelphia este format de translocație (9; 22) (q34; q11) in celulele stem maduvei osoase, care este însoțit de bcr fuziune genică și oncogena abl pentru a forma o bcr himeric / abl și dezvoltarea de leucemie mieloidă cronică (CML). Transcrierea unei gene himerice codifică o proteină p210 bcr / abl. care are o activitate îmbunătățită a tirozin kinazei. O astfel de ARN si proteine se gaseste in aproape toti pacientii cu sindrom de LMC, precum și 50% dintre pacienții cu leucemie acută limfoblastice, care au un cromozom Philadelphia. Cu ribozim clivare specific ARNm himeric în secvențe loc de andocare ale celor două gene a fost capabil să suprime expresia bcr gene himerice / abl în celulele de cultură. Expresia ribozimelor în celulele cultivate cauzate reducerea nivelului bcr / abl ARNm, blocat complet formarea himeric proteina p210 BCR / creșterea celulară abl și a inhibat cu 84%. Aceste rezultate au fost efecte semnificativ mai bune induse de oligonucleotide antisens.
In alți cercetători a fost obținut scindează ribozimă ARN himeric de mai sus codon GUU, situat adiacent la secvențele de andocare de bază ale celor două gene. Acest ribozim distruge ARN adecvat in vitro și in vivo și a inhibat activitatea tirozin kinaza a proteinei p210.