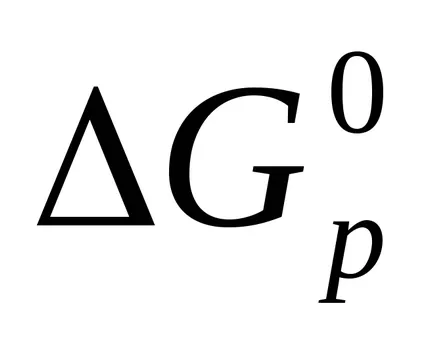regularități generale ale proceselor chimice, energia (termodinamică), procese chimice
Energia internă a sistemului. Căldura. termodinamica Rabota.Izakon. Entalpie. Entalpia materialului formării. Entalpia de reacție. termodinamica Entropiya.IIzakon. Schimbarea entropiei în procesele chimice. energia Gibbs de material formare. energia Gibbs de reacție. Orientarea proceselor chimice.
Termodinamica studiază legile de tranziție a diferitelor tipuri de energie. În reacții chimice, aceste modificări sunt însoțite de absorbția sau eliberarea de energie sub formă de căldură. Reacțiile sunt însoțite de absorbție a căldurii, nazyvayutsyaendotermicheskimi și reacția însoțită de generarea de căldură -ekzotermicheskimi.
Fiecare sistem este în condiții fizice constante are o anumită rezervă de energie, numită energia internă a sistemului / U /. Se compune din energia mișcării și poziționării molecule, atomi, nuclee și electroni și energia provocată de atracția și forțele de repulsie între ele. Cu toate acestea, energia internă nu include energia cinetică a mișcării a sistemului în ansamblul său și energia potențială a stării sistemului în spațiu.
Atunci când orice proces respectat legea conservării energiei. Căldura (q) a rezumat la sistem este consumat în schimbarea internă a energiei (DU) și lucrările de notare (A).
Q = δ u + un
La o presiune constantă (care majoritatea proceselor chimice) lucrează - o lucrare pentru a modifica volumul, adică, A = p · Av, unde p - presiunea din sistem, schimbarea volumului sistemului aΔV- (Vkon -Vnach.).
În acest caz, QP = p · + AU Av
sau qp = (Ukon. -Unach.) + p (Vkon. -Vnach).
q p = (Ukon pVkon + ..) - (+ Unach Vnach p.).
Suma U + pVoboznachayut cherezHi nazyvayutentalpiey. Prin urmare, căldura de reacție (efect termic), cu presiune constantă egală cu variația de entalpie a sistemului:
Entalpie - (? H) funcția termodinamică a stării sistemului, astfel încât valoarea absolută a entalpiei unui sistem nu poate fi determinat și calculat doar modificarea entalpiei .żn termohimicheskihraschotah entalpie este exprimat întotdeauna cherezΔN. Pentru comparație entalpiei (efect termic) procese diferite aceste valori conduc la condiții identice și tabelele predstavlenystandartnye entalpii (
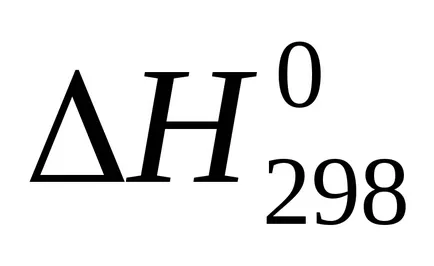
Temperatura de 298 K (25 0 C)
101,3 kPa (1 atm).
Entalpia formării unor substanțe simple, presupuse a fi zero dacă statele lor agregate și modificări sunt stabile în condiții standard.
De exemplu:
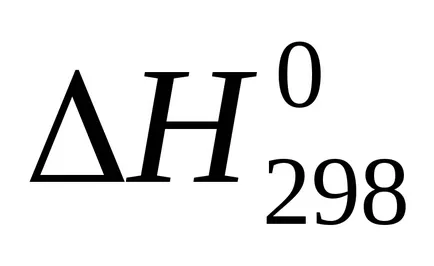
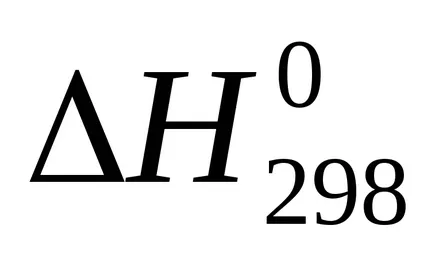
Entalpia de formare a unui compus este entalpia de formare a reacției unui mol de substanță din substanțe simple.
Exemplul 1: Entalpia de formare a apei:
2H2 (g) + O2 (g) = 2H2O (g)
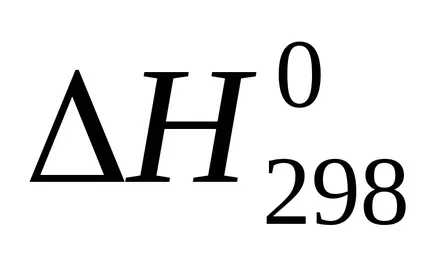
Aceasta implică faptul că entalpia de formare a apei în faza gazoasă este - 484kDzh. = -242 kJ 2 mol / mol
Entalpie este calculat din legea anchetă Hess: „entalpia reacției chimice este suma entalpiile de formare a produșilor de reacție minus suma entalpiile de formare a materiilor prime considerând coeficienții stoichiometrice.“
ΔNr = Σ (n ∙ AH) Cont. - Σ (n ∙ AH) ref ,.
în care numărul de moli de n-.
Exemplul 2. Se calculează căldura de reacție. Se specifică reacția endo- sau exotermă în condiții standard.
Alunițe, n4 5 4 6
enthalpy
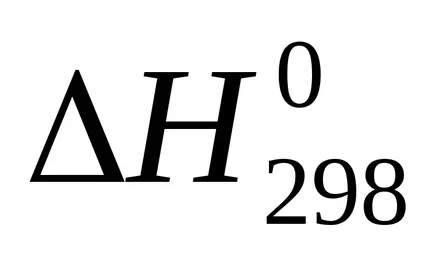
? Reaction H 0 = [4 (+91) +6 (-242)] - [4 (-46) + 5 · 0] = -904kDzh.
Deoarece Δ H<О, данный процесс сопровождается выделением тепла, т.е. является экзотермическим.
Valorile funcțiilor termodinamice la condiții standard
Termodinamicii stabilește, de asemenea, direcția fluxului spontane a proceselor în aceste condiții. La stabilirea caracterului spontan al reacției, sa constatat că reacția exotermă spontană însoțită de (? H<Ο). Однако связь между снижением энтальпии системы и самопроизвольностью протекания процесса является недостаточным фактором.
Un alt factor în determinarea procesului spontan este o funcție termodinamică numită entropie (S). Entropia este o măsură de ordin în starea sistemului. In timpul entropia reacției chimice a modificărilor sistemului. Această reacție schimbare nazyvaetsyaentropiey.
Entropia de reacție este, de asemenea, calculat în conformitate cu investigarea legii Hess.
ΔSp = Σ (n · S) Prod.- Σ (n ∙ S) ref.
Exemplul 3. Se calculează variația de entropie a sistemului de reacție în condiții standard.
Moles, n1 02 ianuarie
entropie
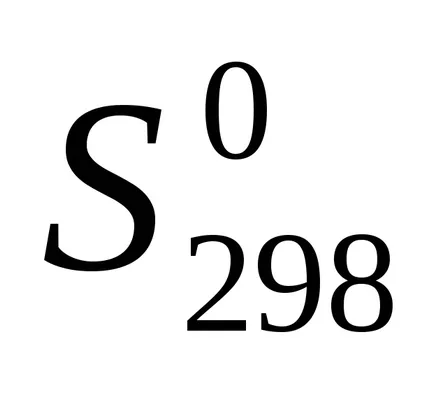
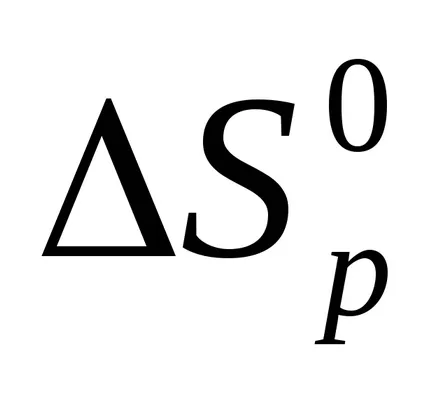
Toate procesele care au loc cu ordinea descrescătoare a sistemului, însoțită de o creștere a entropiei, și vice-versa. Spontan fluxul de procese care au loc cu o creștere a entropiei. Pentru procesele care au loc în izobare - condiții izoterme (p = const, T = const) forța motrice a procesului spontan este tendința sistemului de a trece la un stat cu cel mai mic entalpie (factorul entalpie), sau cu o creștere a entropiei (factor de entropie). O stare stabilă a sistemului corespunde egalității acestor factori.
Funcția termodinamic care arată modul în care sistemul în această stare a deviat de la echilibru, numit energia Gibbs (G).
În cazul în care: AG <0. процесс может протекать самопроизвольно в прямом направлении;
= 0. proces AG în starea de echilibru;
AG> 0. proces spontan în direcția înainte
nu poate avea loc.
Din relația = H AG - T ∙ ΔS se vede că procesele pot continua spontan?:
exotermic (? H <0). Для которых: ∆S> 0.
endoterm (? H> 0). Pentru care: ΔS> 0. dar / T · ΔS > / H /,t.e?. la temperaturi ridicate.
Reaction Gibbs energie este, de asemenea, calculată pentru investigarea legii Hess.
Exemplul 4. Se specifică posibilitatea reacției spontane în condiții standard.
Numărul de moli, n 1 1 2
energia Gibbs,
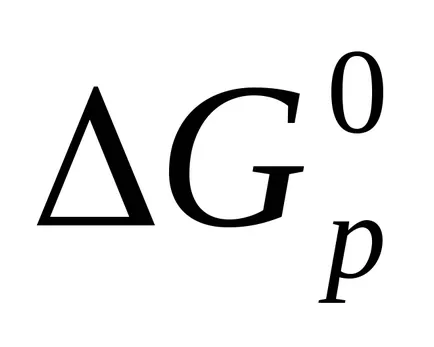
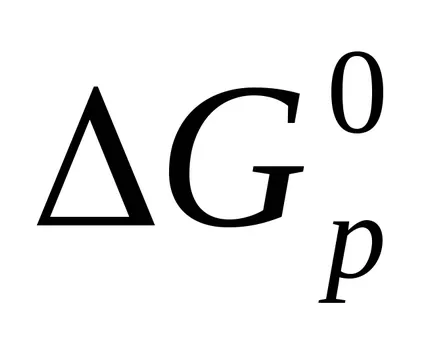
deoarece