Reacțiile de schimb de ioni 1
5. LUCRU DE LABORATOR disociație electrolitică
informații teoretice Scurt
[K m +] n · [A n -] m = const = PR.
Din conceptul de condiții de curgere PR pentru formarea de precipitații
([K + m] n · [A n -] m> OL)
dizolvare și precipitare
([K + m] n · [A n -] m <ПР).
Produsul de solubilitate a unor electroliți greu solubili la 25 ° C, este prezentată în tabelul. 6 aplicații.
Următoarele reguli de scriere reacții ionice:
• Compuși malodissotsiiruyuschih cu formula (gazele de precipitare elktrolitov ioni slab, complex) este înregistrată sub formă moleculară;
• bine Disociindu substanțe cu formula (electroliți puternici) se înregistrează în formă ionică;
• metathesis scrisă într-un ion molecular formă și ionic molecular.
Să considerăm prepararea hidroxid de fier (III) care rezultă din interacțiunea soluțiilor apoase de nitrat de fier (III) și hidroxid de sodiu. Ecuația reacției moleculară:
Fe (NO 3) 3 + 3NaOH = Fe (OH) 3 ↓ +3 NaNO 3
Ecuația reacției Full-ionic:
Fe 3+ + 3NO - 3 + 3NA + + OH - = Fe (OH) 3 ↓ + 3NA + + 3NO - 3
electroliți puternici - pe bază de nitrat de fier (III) și soluție de hidroxid de sodiu sunt prezente ca ioni. hidroxid de fier (III) - un electrolit slab și ionii de fier și ionii hidroxid în soluție nu este aproape formată. Sledovatel-
dar interacționează numai ionii și Fe 3+ OH -. Eliminarea ionilor de Na + și NO - 3 din ambele părți ale ecuației, obținem ecuația ionică redusă:
Fe 3+ + 3OH - = Fe (OH) 3 ↓
Chimie. Lab. lucrări practice
5. LUCRU DE LABORATOR disociație electrolitică
informații teoretice Scurt
Numai interacțiunea acestor ioni reflectă esența procesului, adică. E. Determină direcția reacției, astfel încât ar trebui să utilizați o înregistrare scurtă de ioni.
Experiența 1 Zavisimostelektroprovodnostiotstepenidissotsiatsiielektrolitov
Conductivitatea soluțiilor depinde în mare măsură de gradul de disociere a electrolitului. La aceeași concentrație, este mai mare gradul de disociere a electrolitului, cu atât mai mare valoarea conductivității sale.
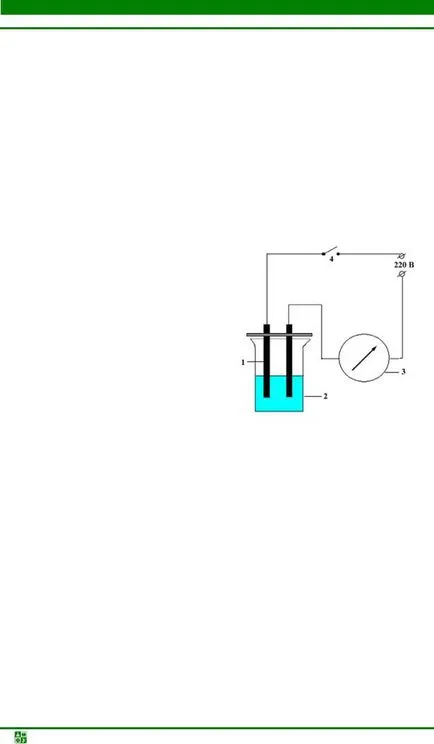
Fig. 5.4. Diagrama schematica determină conductivitatea electrică a soluțiilor: 1 - electrozi de grafit; 2 - paharul soluției de testat; 3 - voltmetru; 4 - Cheie
Pentru a studia conductivitatea electrică a soluțiilor utilizate instrument de diagramă schematică este prezentată în Fig. 5.4. Înainte de experiment dispozitivul include o rețea. 2 din sticlă de 50 ml de fiecare dată umplut cu soluția la 1/2 din volumul său, acea zonă a electrozilor, a coborât în lichidul din toate experimentele au fost aceleași. Electrozii 1 este apoi coborâtă în soluție și numai apoi închide circuitul cu cheia 4.
Se determină conductivitatea următoarele soluții: apă distilată, zaharuri, acid acetic, hidroxid de amoniu, acetat de amoniu și clorură de sodiu. Se spală electrozii cu apă distilată, după fiecare soluție de testare. Soluțiile mamă de conductivitate este evaluată prin deformarea voltmetrului 3, cu atât mai mare deformarea, cu atât mai mare conductivitatea.
Pe baza acestor rezultate, plasați electrolitii în ordinea crescătoare conductivitate electrică. Scrieți ecuațiile de disociere. Pentru electroliții slabi, disociere constantă înregistrare.
Chimie. Lab. lucrări practice

5. LUCRU DE LABORATOR disociație electrolitică
Explicați soluție de acetat de amoniu creșterea conductivității obținută prin drenarea soluțiilor de acid acetic și hidroxid de amoniu, în comparație cu conductivitatea electrică a soluțiilor inițiale.
Experimentul 2 Vliyanierazbavleniyarastvora
Testați conductivitatea concentrat (80%) și se diluează (. 2N) Acid acetic. Uita-te la creșterea deviației săgețile voltmetru de amplitudine într-un caz cu un acid diluat. Concluzii cu privire la direcția de deplasare a soluției de echilibru de diluție disociere.
Experimentul 3 Vliyanieodnoimennogoiona
In experimentul cu ajutorul unui indicator - (. Vezi Tabelul 5.1) fenolftaleină și portocaliu metil, colorația care variază în funcție de forma în care (acidă sau bazică) sunt.
a) Cele două tuburi se toarnă 5 - 7 picături de 0,1N. Soluție de acid acetic și o picătură de indicator metil oranj. Culoarea portocaliu deschis a fost schimbat la roz. Într-unul din tuburi, se adaugă câteva cristale de acetat de sodiu și se agită. Observați schimbarea culorii indicatorului de la roz la portocaliu.
b) două tuburi se toarnă 5 - 7 picături de 0,1N. soluție de amoniac și o picătură de indicator fenolftaleină. Soluția devine roșu. Într-unul din tuburi, se adaugă câteva cristale de clorură de amoniu. Uita-te la o soluție de albire.
Folosind expresia constantele de disociere ale acidului acetic și hidroxid de amoniu (K d (CH3 COOH) = 1,86 · 10 -5 K d (NH4OH) = 1,77 · 10 -5),
explica cauza deplasării echilibrului.
Experiența 4 Opredelenienapravleniyaprotekaniya
Într-un tub de testare cu 5 - 7 picături de soluție de acetat de sodiu, se adaugă 3-4 picături de acid sulfuric (1: 1) și se amestecă ușor se încălzește tubul într-o baie de apă soluții. Se determină formarea de acid acetic
Chimie. Lab. lucrări practice

5. LUCRU DE LABORATOR disociație electrolitică
miros caracteristic. In al doilea tub de umplere 5 - 7 picături de soluție de clorură de amoniu și 3-4 picături de 4N. soluție alcalină, se încălzește soluția. Izolarea amoniacului din tuburi este determinată de mirosul specific.
Se înregistrează ecuația reacției în forma moleculară și ionică. Faceti o concluzie cu privire la direcția de curgere a reacțiilor studiate, utilizate
Folosind constanta de disociere a acidului acetic și hidroxid de amoniu (vezi. 8. adj. Tabel.).
Experiența 5 Poluchenieirastvorenieosadkovmalorastvorimyhelektrolitov
Puțin solubil precipitare și dizolvat prin schimbarea concentrației de ioni care formează compusul conform CR valoarea acestor compuși.
Cele două tuburi se toarnă 1-2 ml de soluție de clorură de 0,1 M CaCl2 de calciu și se adaugă 1,2 ml de M Na2CC soluție de carbonat de sodiu 0,1 3. într-o eprubetă se adaugă un acid clorhidric mic, iar celălalt - acidul acetic Acid. Precipitatul a fost dizolvat într-un tub, în care a fost adăugat acid clorhidric. Explicați rezultatele experimentului, folosind valorile constantelor de disociere ale acizilor și PR CaCO3:
K d (CH3 COOH) = 1,86 · 10 -5; K d (I) (H 2 CO 3) = 4,3 x 10 -7;
K d (II) (H 2 CO 3) = 5,6 · 10 -11; CR = 3,8 x 10 -9.
Scrieți ecuațiile reacțiilor și se dizolvă precipitatul.
EXEMPLU Exemplul 1. Reacția de a forma un electrolit slab:
HCI + KOH = H 2 O + KCl
R e w n e notați ecuația full-ionic .:
H + + Cl - + K + + OH - = H 2 O + K + + Cl -
Reacția a produs un electrolit slab - apă; eliminarea ionilor de sodiu și de clor, ionic obține scurt ecuația:
Exemplu Exemplul 2 pentru a forma un gaz de reacție:
5. LUCRU DE LABORATOR disociație electrolitică
Exemple de soluții de probleme tipice
Na2 CO3 + H 2 SO 4 = Na 2 SO 4 + H 2 CO 3
. R e w n e Ca rezultat al reacției formează un electrolit H slab 2 CO 3. dezintegrează în CO2 și H2O:
2Na + + CO 2 Martie - + 2H + + 2CI - = 2Na + + 2CI - + H 2 O + CO 2 ↑
CO 03 februarie - + 2H + = H 2 O + CO 2 ↑
Exemplul Exemplul 3. Reacția precipitat de dizolvare:
CaCO 3 ↓ + 2HCl = CaCl2 + 2H 2 O
. R e w n e electroliți puternici includ acid clorhidric, clorură de calciu, iar cei slabi - carbonat de calciu și apă, în care apa - un electrolit slab.
Ecuația Full-ionic este
CaCO 3 ↓ + 2H + + 2CI - = Ca 2+ + 2CI - + 2H 2 O
Excluzând ionii de clor, ionic obține scurt ecuația:
CaCO 3 ↓ + 2H + = Ca2 + 2H 2 O
1. Care este principalul motiv pentru disociere? Aceasta depinde de capacitatea electrolitului la disocierea tipului legăturii chimice?
2. Ce substanțe sunt numite electroliți? Pe ce bază sunt împărțite în electroliți puternici și slabi?
3. Scrieți ecuația disocierea electrolitică a faimoaselor acizi puternici și baze în apă.
4. Care este constanta de disociere? Cum diferă de gradul de disociere și ceea ce depinde?
5. În ce condiții reacțiile metabolice au loc până la sfârșitul anului? Dă exemple.
6. Ceea ce se numește produsul de solubilitate? Care sunt condițiile pentru formarea și dizolvarea ploii?
7. Scrierea toate posibilele ecuațiile de disociere electrolitică a acidului carbonic și hidroxid sulfuros, fier (III) și se exprimă în forma generală a constantele lor de disociere.
8. Asigurați ecuația ionice și moleculare ale următoarelor reacții:
a) CH3COOH + NaOH = ... b) Zn (OH) 2 + HNO3 = ...
Chimie. Lab. lucrări practice