reacția Hoffmann
reacția Hoffmann. 1) Conversia amide ale acizilor carboxilici în aminele primare cu eliminarea CO2. se produce sub acțiunea hypohalites metalelor alcaline (Hoffmann rearanjare, Hofmann clivarea amide):
La soluția apoasă alcalină adăugată amidă hipohalogenit: încălzirea ulterioară la 40-80 ° C completează reacția. Pentru a crește randamentul amidelor amine ale acizilor grași superiori, reacția se efectuează în soluție alcoolică. Uretani astfel formate sunt ușor hidrolizat la amine. Prima etapă de reacție Hoffmann - sinteza N-galogenamida care formează sub influența sarea alcalină instabilă a I:
Etapa de definire a vitezei de reacție Hoffmann - eliminarea halogen pentru a forma nitrenă II, care este stabilizat prin rearanjarea în izocianat.
Ultima în interacțiune. cu H2O prin carbamic convertit. o amină:
Sa constatat că grupul de Migrare salvează configurația. anion Fugitive interacțiunii can amidă III. cu conexiune. conținând electrofil. legături multiple. de ex.
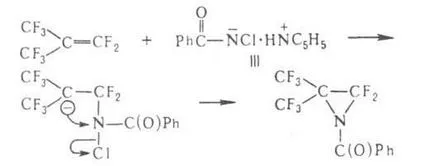
Și amide hidroxiacizi nesaturate la-t la convertit condiții de reacție Hofmann. la aldehide. amide ale k propionic substituite în m-nitrili. acil amide de aminoacizi - în atsilglioksalidony:

Cu Hoffmann reacție poate fi preparat cu randamente bune alifatich. gras aromatic. aromatic. și geterotsiklich. amine. diamine și aminoacizi. Industrial G. p. utilizat pentru sinteza acidului antranilic.
Reacție A. V. Gofmanom deschis în 1881.
2) descompunerea bazelor de amoniu cuaternar având un atom de carbon în lanț N în poziția la atomul de N, la o amină terțiară, olefină și apă (despicarea Hoffman):
De obicei, realizată prin evaporarea unei soluții apoase sau alcoolice de hidroxid de tetraalchilamoniu (adesea sub vid), cu creșterea treptată a temperaturii la 100-150 ° C Folosind un amestec de DMSO anhidru și THF pentru a reduce temperatura de reacție la temperatura camerei. Dacă atomul N asociat în dec. substituenții alchil, în DOS. olefină formată cu cel mai mic număr de grupe alchil pe legătura dublă (tipic Hoffman), de exemplu:
Substituenți la atomul de carbon capabil de împerechere și hidrogen creștere aciditate (de ex. Fenil) facilitează scindarea olefinei. Dacă există legătură multiplă este clivat la atomul de hidrogen poziția și se produce 1,4-eliminare, de exemplu:
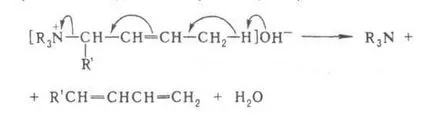
În cazul a două legături conjugate are loc la poziția 1,6-trienă eliminare și formate, de exemplu:
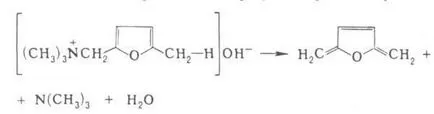
reacția Hoffmann are loc de obicei prin mecanismul de eliminare bimolecuă și stereospecificitatea, în unele cazuri - un ciclice intramoleculare. mecanism, de exemplu.
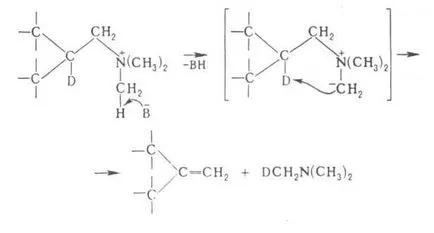
unde B - bazele.
Principalele procese de reacție laterală la Hoffmann - formarea de alcooli și eteri, epoxizi, derivați de THF și ciclopropan. Reacția este similar cu reacția Hofmann veni săruri de sulfoniu și săruri de fosfoniu, cum ar fi:
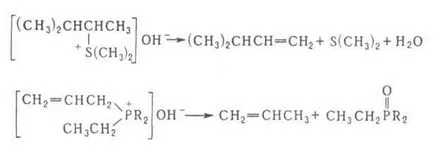
reacția Hofmann utilizat pentru sinteza compușilor nesaturați. Metilarea secvențială a aminelor și scindarea lor (t. Chemat. Metilare exhaustiva) este utilizat pentru a identifica amine.
Reacție A. V. Gofmanom deschis în 1851.